
|
Читайте также: |
При рассмотрении модели, показанной на рис. 6, делаются допущения, что диффузия в зерно происходит как диффузия к плоской стенке, концентрация па внешней границе пленки остается постоянной.

Рис. 6. Изменение концентрации иона при переходе из жидкой (пульповой) фазы в зерно при внешнедиффузиониой (а), внутридиффузионной (б, в) и смешанной (г) кинетике [27]: 1,3 – ядро потока и зерна соответственно; 2 – граница раздела фаз; в – при линейном градиенте концентрации в зерне; τ 0 – время, необходимое для достижения концентрационной волной центра зерна
Градиент концентрации в ионите и на границе пленка – ионит отсутствует, что связано с быстрым выравниванием концентрации в зерне. В пленке концентрация меняется линейно. На границе жидкость – ионит существует равновесие для всех концентраций от 0 до х (y δ = αр x δи у р = αp х).
При внешнедиффузионной кинетике скорость процесса определяется первым законом Фика (уравнение 16). Массовый поток через пленку для зерен сферической формы при учете, что  , имеет вид:
, имеет вид:
 . (18)
. (18)
После несложных преобразований [17] уравнение (18) приводится к удобной для практического использования форме:
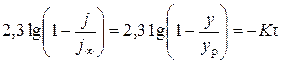 ,
,
где константа скорости
 ,
, 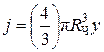 ,
,  .
.
Зная К, можно определить коэффициент скорости β1 (коэффициент массоотдачи) при α=const и коэффициент диффузии через пленку D ж:
 ,
,
 .
.
Толщина пленки зависит от режима течения раствора и изменяется в пределах от 100 до 10 мкм, иногда при турбулентном режиме достигает 1 мкм [2, 22] и может быть найдена при малых скоростях потока по уравнению
 .
.
Значение коэффициента диффузии в растворах D жколеблется в пределах 10–4–10–5 см2/с.
С помощью коэффициента диффузии можно найти время полуобмена
 .
.
Для внешнедиффузионной кинетики характерны следующие признаки [2]: энергия активации в 1,1–2,5 раза выше, чем при внутридиффузионной, и составляет 17–25 кДж/моль, скорость процесса обратно пропорциональна радиусу зерна, константа скорости К обратно пропорциональна коэффициенту распределения αр, линейно увеличивается при повышении концентрации сорбируемого элемента в растворе и скорости его перемешивания или фильтрации через слой ионита, скорость реакции не зависит от степени сшивки ионита.
Внешняя диффузия лимитирует процесс в очень разбавленных растворах х< 0,001 М. При концентрации ионов выше 0,001 М диффузионный поток начинает увеличиваться, возрастает роль диффузии в зерне.
Дата добавления: 2015-10-29; просмотров: 263 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Кинетика ионного обмена | | | Гелевая кинетика |