
Читайте также:
|
Белки, распадаясь в организме, являются, так же как углеводы и жиры, источником энергии. Энергия, получаемая при распаде белков, может быть без всякого ущерба для организма компенсирована энергией распада жиров и углеводов. Однако организм человека и животных не может обходиться без регулярного поступления белков извне, так как пластическая роль белков (участие в построении разнообразных клеточных структур) неизмеримо превосходит их энергетическую ценность. Без белков и их составных частей – аминокислот – не может быть обеспечено воспроизводство основных структурных элементов органов и тканей, а также образование ряда важнейших веществ, например нуклеиновых кислот и гормонов. Степень усвоения организмом белка характеризует биологическую ценность последнего, которая будет тем выше, чем ближе аминокислотный состав пищевого белка к составу белков данного организма. Биологическая ценность белка определяется не только его аминокислотным составом, но и возможностью расщепления белка ферментами. В тесной связи с вопросом о биологической ценности белка находится представление о так называемых незаменимых и заменимых аминокислотах.
Необходимость ряда аминокислот для развития того или иного организма и обязательность введения их с пищей обусловлена тем, что организм неспособен их синтезировать. К незаменимым аминокислотам относятся: валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан и лизин. Таким образом, огромное значение в питании человека и сельскохозяйственных животных имеет рациональный подбор белков пищи.
Белки, вводимые с пищей в организм, никогда не включаются в состав тканей и органов без предварительного их расщепления. Распад белковых веществ на более простые, лишенные видовой и тканевой специфичности соединения осуществляется при участии ряда ферментов класса гидролаз. Гидролиз белков может быть либо частичным (до пептидов), либо полным (до аминокислот). Процесс неполного гидролиза белков, при котором распадаются лишь некоторые пептидные связи, ускоряется специфическими ферментами – протеиназами (пептидилпептидогидролазами), важнейшими из которых являются трипсин, пепсин и химотрипсин.
Названные ферменты выделяются слизистой стенкой кишечного тракта в неактивной форме, т.е. в виде преферментов – препепсина, претрипсина и прехимотрипсина. Под влиянием соляной кислоты желудочного сока или специфических ферментов кишечника преферменты переходят в активную форму. При превращении, например, претрипсина в трипсин происходит отщепление гексапептида от N-конца пептидной цепи префермента под действием фермента энтерокиназы. Специфичность действия протеиназ рассмотрена ранее в подразд. 1.7.
Пептиды, образовавшиеся в результате действия на белки протеиназ, подвергаются дальнейшему расщеплению до аминокислот при участии пептидаз: карбоксипептидаз (отщепляют аминокислоты от С-конца пептида), аминопептидаз (отщепляют аминокислоты от N-конца пептида) и дипептидгидролаз (расщепляют дипептиды). В результате совместного действия протеолитических ферментов (протеиназ и пептидаз) белки пищи распадаются до аминокислот. Свободные аминокислоты претерпевают в организме человека и животных различные превращения: часть их используется для синтеза белков органов и тканей, часть затрачивается на синтез гормонов, витаминов и т.п.; часть же, подвергаясь полному распаду, используется в качестве энергетического материала.
Общая схема гидролиза белков в организме показана на рис. 8.1.
В организме осуществляются три типа превращений аминокислот: по а-аминогруппе, по карбоксильной группе и по радикалу.
Реакции по а-аминогруппе аминокислот – это в основном реакции дезаминирования и переаминирования. Дезаминирование аминокислот может идти различными путями, но главный из них – окислительное дезаминирование, которое осуществляется в две стадии.

Сначала аминокислота окисляется в иминокислоту при участии специфической дегидрогеназы с НАД+ или НАДФ+ в качестве коферментов:

Образовавшаяся глутаминовая кислота вслед за этим претерпевает окислительное дезаминирование, а выделяющаяся при этом а-кетоглутаровая кислота снова вовлекается в реакцию переаминирования с L-аминокислотами.
Реакция переаминирования между L-аминокислотами и а-кетоглутаровой кислотой является обратимой, поэтому при определенных условиях она служит для синтеза L-аминокислот из кетокислот и глутаминовой кислоты. Коферментом трансаминаз выступает витамин В6.
Реакции по карбоксильным группам аминокислот сводятся в основном к двум процессам: декарбоксилированию и образованию аминоациладенилатов.
Реакция декарбоксилирования монокарбоновых аминокислот сопровождается выделением СО2 и образованием аминов:

Он вызывает усиление деятельности желез внутренней секреции, а также снижает кровяное давление. В ряде случаев при декарбоксилировании аминокислот образуются иные продукты. Например, при декарбоксилировании глутаминовой кислоты образуется у-аминомасляная кислота:

Она накапливается в мозговой ткани и представляет собой нейрогуморальный ингибитор. Аналогично этому из аспарагиновой кислоты получается β-аланин.
Другой важной реакцией аминокислот по СООН-группе является образование ими аминоациладенилатов (см. подразд. 8.3).
Важнейшим типом химических превращений аминокислот, протекающих с видоизменением радикалов, является переход одних аминокислот в другие, что расширяет возможности синтеза аминокислот. Например, при окислении фенилаланина образуется тирозин:

Аминокислоты, которые не были вовлечены в процессы синтеза тканевых белков или их специфических производных (например, некоторых гормонов гипофиза, щитовидной железы, надпочечников и т.п.) и оказались, таким образом, неиспользованными, подвергаются необратимым процессам распада до конечных продуктов.
Конечными продуктами распада аминокислот в организме являются: аммиак, мочевина, углекислый газ и вода. Вода поступает в общий метаболический фонд, углекислый газ беспрепятственно выводится из организма. Аммиак непосредственно или в виде солей аммония выводится в окружающую среду только у некоторых обитателей гидросферы (крабов, речных раков и др.). Аммиак является токсичным соединением, уже в небольших концентрациях оказывающим вредное влияние на жизнедеятельность организмов. В связи с этим он переводится в безвредные для организма соединения, к числу которых принадлежат аспарагин, глутамин и мочевина.
У человека и большинства позвоночных животных (млекопитающих, амфибий, некоторых рыб и черепах) аммиак связывается и выделяется в виде мочевины, которая является главным конечным продуктом азотистого обмена. Реакции образования аспарагина и глутамина широко представлены в растениях. Путь биосинтеза мочевины из углекислого газа и аммиака у животных (в печени) получил название орнитинового цикла.
Заключительной реакцией в цикле биосинтеза мочевины является гидролиз аргинина на орнитин и мочевину. Суть функционирования орнитинового цикла заключается в том, что из каждых двух молекул аммиака и одной молекулы углекислого газа получается одна молекула мочевины.
Механизм токсического действия аммиака на мозг и организм в целом, очевидно, связан с действием его на несколько функциональных систем.
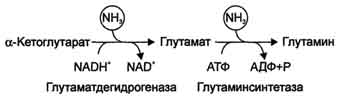
α-Кетоглутарат + NADH + Н+ + NH3 → Глутамат + NAD+.
Уменьшение концентрации α-кетоглутарата вызывает:
· угнетение обмена аминокислот (реакции транса-минирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.);
· гипоэнергетическое состояние в результате снижения скорости ЦТК.
Недостаточность α-кетоглутарата приводит к снижению концентрации метаболитов ЦТК, что вызывает ускорение реакции синтеза оксалоацетата из пирувата, сопровождающейся интенсивным потреблением СО2. Усиленное образование и потребление диоксида углерода при гипераммониемии особенно характерны для клеток головного мозга.
Глутамат + NH3 + АТФ → Глутамин + АДФ + Н3Р04.
· Накопление глутамина в клетках нейроглии приводит к повышению осмотического давления в них, набуханию астроцитов и в больших концентрациях может вызвать отёк мозга. Снижение концентрации глутамата нарушает обмен аминокислот и нейромедиаторов, в частности синтез у-аминомасляной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги.
Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутамин-синтетазы:

Глутаминсинтетаза локализована в митохондриях клеток, для работы фермента необходим кофактор - ионы Mg2+. Глутаминсинтетаза - один из основных регуляторных ферментов обмена аминокислот и аллостерически ингибируется АМФ, глюкозо-6-фосфатом, а также Гли, Ала и Гис.
Глутамин легко транспортируется через клеточные мембраны путём облегчённой диффузии (для глутамата возможен только активный транспорт) и поступает из тканей в кровь. Основными тканями-поставщикам:и глутамина служат мышцы, мозг и печень. С током крови глутамин транспортируется в кишечник и почки.
В клетках кишечника под действием фермента глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
 Образовавшийся в реакции глутамат подвергается трансаминированию с пируватом. ос-Аминогруппа глутаминовой кислоты переносится в состав аланина (рис. 9-10). Большие количества аланина поступают из кишечника в кровь воротной вены и поглощаются печенью. Около 5% образовавшегося аммиака удаляется в составе фекалий, небольшая часть через воротную вену попадает в печень, остальные ~90% выводятся почками.
Образовавшийся в реакции глутамат подвергается трансаминированию с пируватом. ос-Аминогруппа глутаминовой кислоты переносится в состав аланина (рис. 9-10). Большие количества аланина поступают из кишечника в кровь воротной вены и поглощаются печенью. Около 5% образовавшегося аммиака удаляется в составе фекалий, небольшая часть через воротную вену попадает в печень, остальные ~90% выводятся почками.

Рис. 9-10. Метаболизм азота глутамина в кишечнике.
В почках также происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой (рис. 9-11). Эта реакция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается.
В почках образуется и выводится около 0,5 г солей аммония в сутки.
Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин - основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых
Рис. 9-11. Метаболизм амидного азота глутамина в почках.
нуклеотидов, аспарагина, аминосахаров и других соединений (рис. 9-12).

Рис. 9-12. Пути использования глутамина в организме.
Ещё одной реакцией обезвреживания аммиака в тканях можно считать синтез аспарагина под действием аспарагинсинтетазы.


Существуют 2 изоформы этого фермента - глутаминзависимая и аммиакзависимая, которые используют разные доноры амидных групп. Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных. Однако такой путь обезвреживания аммиака в клетках человека используется редко и к тому же требует больших энергетических затрат (энергию двух макроэргических связей), чем синтез глутамина.
Наиболее значительные количества аммиака обезвреживаются в печени путём синтеза мочевины. В первой реакции процесса аммиак связывается с диоксидом углерода с образованием карбамоилфосфата, при этом затрачиваются 2 молекулы АТФ. Реакция происходит в митохондриях гепатоцитов под действием фермента карбамоилфос-фатсинтетазы I. Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе гшримидиновых нуклеотидов (см. раздел 10). Карбамоилфосфат затем включается в орнитиновый цикл и используется для синтеза мочевины.
 В мозге и некоторых других органах может протекать восстановительное аминирование α -кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
В мозге и некоторых других органах может протекать восстановительное аминирование α -кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
Из мышц и кишечника избыток аммиака выводится преимущественно в виде аланина. Этот механизм необходим, так как активность глутаматдегидрогеназы в мышцах невелика и непрямое дезаминирование аминокислот малоэффективно. Поэтому в мышцах существует ещё один путь выведения азота. Образование аланина в этих органах можно представить следующей схемой (см. схему ниже).
Аминогруппы разных аминокислот посредством реакций трансаминирования переносятся на пируват, основным источником которого служит процесс окисления глюкозы.
Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления
Схема
глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада аминокислот. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается, а пируват включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до пирувата (рис. 9-13).
Образование аланина в мышцах, его перенос в печень и перенос глюкозы, синтезированной в печени, обратно в мышцы составляют глюкозо-аланиновый цикл, работа которого сопряжена с работой глюкозо-лактатного цикла (см. раздел 7).
Совокупность основных процессов обмена аммиака в организме представлена на рис. 9-14. Доминирующими ферментами в обмене аммиака служат глутаматдегидрогеиаза и глутаминсинтетаза.

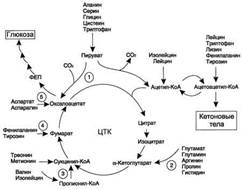
 Рис. 9-16. Орнитиновый цикл Кребса-Гензелейта. Окислительное дезаминирование глутамата происходит в митохондриях. Ферменты орнитинового цикла распределены между митохондриями и цитозолем. Поэтому необходим трансмембранный перенос глутамата, цитруллина и орнитина с помощью специфических транслоказ. На схеме показаны пути включения азота двух разных аминокислот (аминокислота 1 и аминокислота 2) в молекулу мочевины: • одна аминогруппа - в виде аммиака в матриксе митохондрии; • вторую аминогруппу поставляет аспартат цитозоля.
Рис. 9-16. Орнитиновый цикл Кребса-Гензелейта. Окислительное дезаминирование глутамата происходит в митохондриях. Ферменты орнитинового цикла распределены между митохондриями и цитозолем. Поэтому необходим трансмембранный перенос глутамата, цитруллина и орнитина с помощью специфических транслоказ. На схеме показаны пути включения азота двух разных аминокислот (аминокислота 1 и аминокислота 2) в молекулу мочевины: • одна аминогруппа - в виде аммиака в матриксе митохондрии; • вторую аминогруппу поставляет аспартат цитозоля.
Гипераммониемия
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови - гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Известны пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла (табл. 9-4).
В литературе описаны случаи всех этих довольно редких энзимопатий, среди которых отмечено больше всего случаев гипераммониемии II типа.
Нарушение орнитинового цикла наблюдается при гепатитах различной этиологии и некоторых других вирусных заболеваниях. Например, установлено, что вирусы гриппа и других острых респираторных вирусных инфекций снижают активность карбамоилфосфатсинтетазы I. При циррозе и других заболеваниях печени также часто наблюдают гипераммониемию.
Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников. Так, при дефекте аргининосук-цинатсинтетазы повышается содержание цитруллина (цитруллинемия); при дефекте аргиназы - концентрация аргинина, аргининосукцината, цитруллина и т.д. При гипераммониемиях I и II типа вследствие дефекта орнитинкарбамоилтрансферазы происходит накопление карбамоилфосфата в митохондриях и выход его в цитозоль. Это вызывает увеличение скорости синтеза пиримидиновых нуклеотидов (вследствие активации карбамоилфосфатсинтетазы II), что приводит к накоплению оротата, уридина и урацила и выведению их с мочой. Содержание всех метаболитов повышается, и состояние больных ухудшается при увеличении количества белков в пище. Тяжесть течения заболевания зависит также от степени снижения активности ферментов.
Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака, глутамина и аланина.
Гипераммониемия сопровождается появлением следующих симптомов:
Таблица 9-4. Наследственные нарушения орнитинового цикла и основные их проявления
| Заболевание | Дефект фермента | Тип наследования | Клинические проявления | Метаболиты | |
| кровь | моча | ||||
| Гиперам- мониемия, тип I | Карбамоил- фосфат- синтетаза I | Аутосомно- рецессивный | В течение 24-48 ч после рождения кома, смерть | Глн Ала NH3 | Оротат |
| Гиперам- мониемия, тип II | Орнитин- карбамоил- трансфераза | Сцепленный с Х-хромосомой | Гипотония, снижение толерантности к белкам | Глн Ала NH3 | Оротат |
| Цитрул- линемия | Аргинино- сукцинат- синтетаза | Аутосомно- рецессивный | Гипераммониемия тяжёлая у новорождённых. У взрослых - после белковой нагрузки | Цитруллин NH3 | Цитруллин |
| Аргинино- сукцина- турия | Аргинино- сукцинат- лиаза | Аутосомно-рецессивный | Гипераммонимия, атаксия, судороги, выпадение волос | Аргини- носукцинат NH3 | Аргини- носукци- нат, Глн, Ала, Лиз |
| Гиперар- гининемия | Аргиназа | Аутосомно-рецессивный | Гипераргининемия | Apr NH3 | Apr Лиз Орнитин |
Все симптомы гипераммониемии - проявление действия аммиака на ЦНС (см. выше подраздел IV, Б).
Для диагностики различных типов гипераммониемии производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, акгивности фермента в биоптатах печени.
 Основной диагностический признак -повышение концентрации аммиака в крови. Содержание аммиака в крови может достигать 6000 мкмоль/л (в норме - 60 мкмоль/л). Однако в большинстве хронических случаев уровень аммиака может повышаться только после белковой нагрузки или в течение острых осложнённых заболеваний.
Основной диагностический признак -повышение концентрации аммиака в крови. Содержание аммиака в крови может достигать 6000 мкмоль/л (в норме - 60 мкмоль/л). Однако в большинстве хронических случаев уровень аммиака может повышаться только после белковой нагрузки или в течение острых осложнённых заболеваний.
Лечение больных с различными дефектами орнитинового цикла в основном направлено на снижение концентрации аммиака в крови за счёт малобелковой диеты, введения кетоаналогов аминокислот в рацион и стимуляцию выведения аммиака в обход нарушенных реакций:
Вводимый больным с дефектом карбамоил-фосфатсинтетазы I в качестве пищевой добавки фенилацетат в результате его конъюгации с глутамином образует фенилацетилглутамин, который экскретируется почками. Состояние больных при этом улучшается, так как происходит активация синтеза глутамина и снижение концентрации аммиака в крови (рис. 9-19, А).
Аналогичное действие оказывает введение бензоата, который связывает молекулу глицина. Образующаяся пшпуровая кислота выводится с мочой (рис. 9-19, Б). В составе гиппурата происходит выделение азота из организма. Недостаток глицина компенсируется либо путём синтеза его из серина, либо за счёт образования из NH3 и СО2 в реакции, катализируемой глицинсинтетазой. При этом образование глицина сопровождается связыванием одной молекулы аммиака.
При гипераммониемии II типа (дефект орнитинкарбамоилтрансферазы) введение больших
Рис. 9-19. Пути выведения аммиака при включении в диету глутамата и фенилацетата (А), бензоата (Б), цитруллина и аргинина (В). На рисунке обозначены ферментные блоки: 1 - дефект карбамоилфосфатсинтетазы I; 2-дефект орнитинкарбамоилтрансферазы; 3 - дефект аргининосукцинатлиазы.
доз цитруллина стимулирует синтез мочевины из аспартата (рис. 9-19, В), что также приводит к вьшедению азота из организма. Введение больших доз аргинина при аргининосукцинатурии (дефект аргининосукцинатлиазы) стимулирует регенерацию орнитина и выведение азота в составе цитруллина и аргининосукцината.
1. Особенности обмена метионина
Метионин - незаменимая аминокислота. Она необходима для синтеза белков организма, участвует в реакциях дезаминирования, является источником атома серы для синтеза цистеина. Метионил-тРНК участвует в инициации процесса трансляции.
Метальная группа метионина - мобильный одноуглеродный фрагмент, используемый для синтеза ряда соединений. Перенос метильной группы метионина на соответствующий акцептор называют реакцией трансметилирования, имеющей важное метаболическое значение.
Метальная группа в молекуле метионина прочно связана с атомом серы, поэтому непосредственным донором этого одноутлеродного фрагмента служит активная форма аминокислоты.
Дата добавления: 2015-09-01; просмотров: 157 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Обмен дикарбоновых аминокислот | | | Синтез карнитина |