
|
Читайте также: |
1. Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению α-карбоксильной группы. Продуктами реакции являются СО2 и биогенные амины (табл. 9.7). Образование биогенных аминов происходит с участием ферментов декарбоксилаз в присутствии кофермента пиридоксальфосфата.
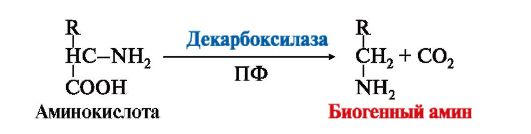 Биогенные амины являются биологически активными веществами, выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК), гормонов (адреналин), регуляторных факторов местного действия (гистамин).
Биогенные амины являются биологически активными веществами, выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК), гормонов (адреналин), регуляторных факторов местного действия (гистамин).
2. В нервных клетках декарбоксилирование глутамата приводит к образованию γ-аминомасляной кислоты (ГАМК), которая является основным тормозным медиатором. Инактивации ГАМК происходит либо путем трансаминирования и превращения в сукцинат, являющийся метаболитом ЦТК, либо окислительным путем под действием моноаминооксидазы (МАО)
(рис. 9.25).
 Рис. 9.25. Схема синтеза и инактивации ГАМК
Рис. 9.25. Схема синтеза и инактивации ГАМК
ГАМК в виде препаратов гаммалон или аминалон применяют при нарушениях мозгового кровообращения, умственной отсталости, эндогенных депрессиях и травмах головного мозга.
3. В нервной ткани из серина синтезируется ацетилхолин, который также относится к биогенным аминам:
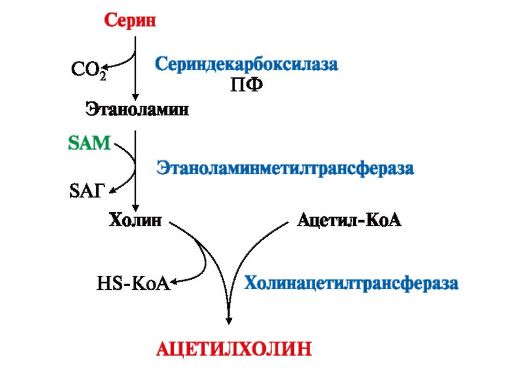 Нарушение образования ацетилхолина в синапсах может вызвать миастению - мышечную слабость.
Нарушение образования ацетилхолина в синапсах может вызвать миастению - мышечную слабость.
4. Серотонин - нейромедиатор проводящих путей, образуется в гипоталамусе, надпочечниках из аминокислоты триптофана:
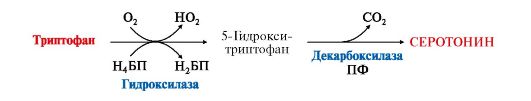 Серотонин представляет собой биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, перистальтику кишечника, оказывает сосудосуживающий эффект, регулирует артериальное давление, температуру тела, дыхание, обладает антидепрессантным действием («гормон удовольствия»), принимает участие в аллергической реакции, поскольку в небольших количествах синтезируется в тучных клетках.
Серотонин представляет собой биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, перистальтику кишечника, оказывает сосудосуживающий эффект, регулирует артериальное давление, температуру тела, дыхание, обладает антидепрессантным действием («гормон удовольствия»), принимает участие в аллергической реакции, поскольку в небольших количествах синтезируется в тучных клетках.
5. К биогенным аминам относятся и катехоламины (дофамин, норадреналин и адренамин) (см. рис. 9.23, В).
Таблица 9.7. Биологическая роль и предшественники некоторых биогенных аминов
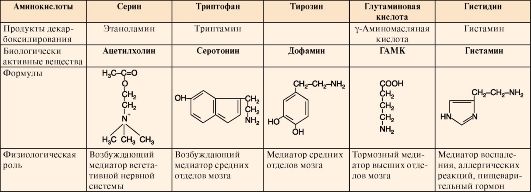 6. Инактивация биогенных аминов происходит двумя путями:
6. Инактивация биогенных аминов происходит двумя путями:
• метилирование с участием SAM под действием метилтрансфераз - характерно для гистамина, адреналина, норадреналина:
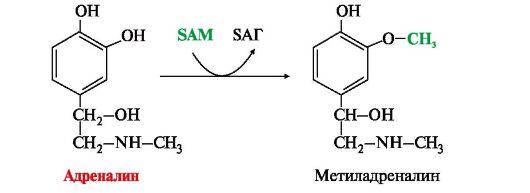 окисление ферментами моноаминооксидазами (МАО) с коферментом FAD - характерно для дофамина, норадреналина, серотонина, ГАМК.
окисление ферментами моноаминооксидазами (МАО) с коферментом FAD - характерно для дофамина, норадреналина, серотонина, ГАМК.
При окислении биогенных аминов происходит дезаминирование и образование альдегида, а затем кислоты, которые выводятся почками:

1. Белки являются одним из важнейших элементов живого организма, именно поэтому мы начнем с описания роли и строения именно этого класса биоорганических соединений. Белки в организме выполняют следующие функции:
1. Структурная или пластическая функция. Белки являются универсальным строительным материалом, из которого состоят практически все структуры живых клеток. Например, в организме человека белки составляют около 1/6 от массы тела. Причем, у тренированных людей с хорошо развитыми мышцами эта цифра может быть и выше.
2. Каталитическая функция. Многие белки, называемые ферментами или энзимами, выполняют в живых системах функцию катализаторов, то есть изменяют скорости протекания химических реакций (о чем подробно будет сказано ниже).
3. Сократительная функция. Именно белковые молекулы лежат в основе всех форм движения живых систем. Мышечное сокращение = это, прежде всего работа белков.
4. Регуляторная функция. В основе этой функции лежит способность белковых молекул реагировать и с кислотами и основаниями, называемых в химии амфотерностью. Белки участвуют в создании гомеостаза(поддержание постоянства внутренней стреды) организма. Многие белки являются гормонами.
5. Рецепторная функция. В основе этой функции лежит способность белков реагировать на возникающие изменения условий внутренней среды организма. Различные рецепторы в организме, чувствительные к температуре, давлению, освещенности являются белками. Рецепторы гормонов – это тоже белки.
6. Транспортная функция. Белковые молекулы имеют большой размер, хорошо растворимы в воде, что позволяет им легко перемещаться по водным растворам и переносить различные вещества. Например, гемоглобин переносит газы, альбумины крови переносят жиры и жирные кислоты.
7. Защитная функция. Белки защищают организм, прежде всего, участвуя в создании иммунитета.
8. Энергетическая функция. Белки не являются главными участниками энергетического обмена, но все же до 10% суточной потребности организма в энергии обеспечивают именно они. В то же время, это слишком ценный продукт, чтобы использовать его, как источник энергии. Поэтому белки используются в качестве источника энергии только после углеводов и жиров.
По материал Интернет
Изучение проблемы нормы белка в питании человека имеет, кроме академического интереса, большое социальное значение. Принятые в нашей стране нормы белка для взрослого человека и для детей разного возраста основаны на результатах многочисленных научных исследований отечественных ученых, учитывают разные климатические условия, условия труда, профессию, возраст и другие факторы. Эти нормы выводятся из оптимального содержания белка в пищевом рационе. Так, взрослый человек, занимающийся умственным трудом или подвергающийся средней физической нагрузке (полностью механизированный труд), должен получать 100–120 г белкав сутки при трате общего количества энергии 12000 кДж. При изменении условий труда (недостаточно механизированный труд) и больших тратах энергии нормабелка увеличивается на 10 г на каждые 2100 кДж. Рабочие, выполняющие тяжелую физическую работу, должны получать 130–150 г белка в сутки.
Потребности в белках детей определяются в первую очередь возрастом и массой тела. Дети даже раннего детского возраста нуждаются в 55–72 г белка в сутки. С возрастом (от 12 до 15 лет) эта норма увеличивается до суточной нормы взрослого человека. Суточные потребности в белке резко возрастают прибеременности и лактации, а также при некоторых патологических состояниях, когда организм теряет белок с мочой или асцитной жидкостью, экссудатами при нефритах, тяжелых инфекционных заболеваниях, ожогах, травмах и т.д.
На долю аминокислот (в составе белков и свободных) приходится более 95 % всего азота организма. Поэтому об общем состоянии аминокислотного и белкового обмена можно судить по азотистому балансу, т. е. разнице между количеством азота,поступающего с пищей, и количеством выделяемого азота (главным образом в составе мочевины).
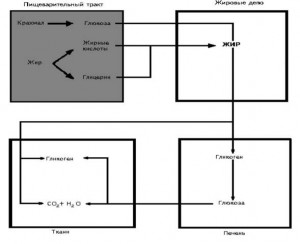
Азотистый баланс - схема.
У взрослого здорового человека при нормальном питании имеет место азотистое равновесие, т. е. количество выделяемого азота равно количеству поступающего. В период роста организма, а также при выздоровлении после истощающих заболеваний выводится азота меньше, чем поступает, — положительный азотистый баланс. При старении, голодании и в течение истощающих заболеваний азота выводится больше, чем поступает, — отрицательный азотистый баланс.
При положительном азотистом балансе часть аминокислот пищи задерживается в организме, включаясь в состав белков и клеточных структур; общая масса белков в организме увеличивается. Наоборот, при отрицательном азотистом балансе общая масса белков уменьшается (катаболическое состояние).
Если из диеты исключить все белки, но полностью сохранить другие компоненты в количествах, обеспечивающих энергетические потребности организма, то азотистый баланс становится отрицательным. Примерно через неделю пребывания на такой диете количество выводимого азота стабилизируется, достигая величины около 4 г за сутки. Такое количество азота соответствует 25 г белка (или аминокислот). Следовательно, при белковом голодании организм ежесуточно расходует около 25 г белков собственных тканей. Практически такой же результат получается при исключении из диеты не всех белков, а только незаменимых аминокислот или даже только одной из них.
При полном голодании отрицательный азотистый баланс еще больше, чем при исключении из пищи только белков. Это обусловлено тем, что аминокислоты, образующиеся при распаде тканевых белков, при полном голодании используются также и для обеспечения энергетических потребностей организма.
В рационе, достаточном по калорийности, минимальное количество белков, необходимое для поддержания азотистого равновесия, составляет 30-50 г. Однако это количество не обеспечивает оптимума для здоровья и работоспособности. Взрослый человек при средней физической нагрузке должен получать о100коло 100 г белков в сутки.
2. В пищевых продуктах содержание свободных аминокислот очень мало. Подавляющее их количество входит в состав белков, которые гидролизуются
в ЖКТ под действием ферментов протеаз (пептидщцролаз). Субстратная специфичность этих ферментов заключается в том, что каждый из них с наибольшей скоростью расщепляет пептидные связи, образованные определёнными аминокислотами. Протеазы, гидролизующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз. Ферменты, относящиеся к группе экзопептидаз, гидролизуют пептидную связь, образованную концевыми аминокислотами. Под действием всех протеаз ЖКТ белки пищи распадаются на отдельные аминокислоты, которые затем поступают в клетки тканей.
Дата добавления: 2015-09-01; просмотров: 1064 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| В печени фенилаланинметаболизируется двумя путями. Большая часть не использованного для синтеза белков Фен (до 80%) превращается в тирозин | | | Образование и роль соляной кислоты |