
Читайте также:
|
1. Мочевина - конечный продукт азотистого обмена, в составе которого из организма выводится избыток аммиака. Экскреция мочевины в норме составляет -25 г/сут. Синтез мочевины происходит только в печени (рис. 9.10).
Содержание мочевиныв сыворотке крови в норме составляет 2,5-8,4 мМ/л (15-50 мг/дл).
Катаболизм аминокислот и образование аммиака происходит во многих тканях. Азот из тканей транспортируется в печень в составе трех соединений: глутамина, аланина и аммиака.
Полный набор ферментов цикла синтеза мочевины есть только в гепатоцитах. Первые две реакции протекают в митохондриях, а последующие три - в цитозоле.
Молекула мочевины (карбамида, двойного амида угольной кислоты) содержит два атома азота:
• первая аминогруппа (ем. рис. 9.10) включается в цикл в виде аммиака, образующегося в митохондриях гепатоцитов при дезаминировании аминокислот или поступающего из крови. Реакцию катализирует митохондриальная карбамоилфосфатсинтетаза I (цитоплазматическая карбамоилфосфатсинтетаза II участвует в синтезе пиримидиновых нуклеотидов);
• вторая аминогруппа (см. рис. 9.10) вводится в молекулу мочевины из аспартата.
2. Аммиак, используемый карбамоилфосфатсинтетазой I, поставляется в печень, главным образом, из кишечника с кровью воротной вены. Роль других источников, в том числе окислительного дезаминирования глутамата и гидролиза глутамина в печени, существенно меньше.
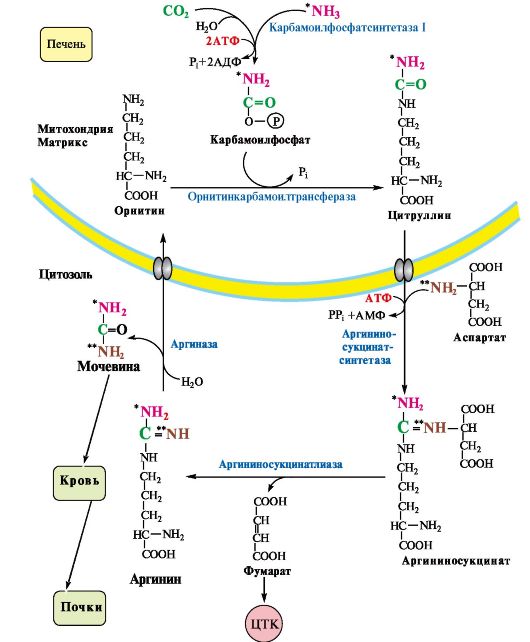 Рис. 9.10. Орнитиновый цикл Кребса-Гензелейта.
Рис. 9.10. Орнитиновый цикл Кребса-Гензелейта.
Ферменты орнитинового цикла локализованы в митохондриях и цитозоле гепатоцитов. В цикле происходит трансмембранный перенос цитруллина и орнитина. На схеме показаны пути включения двух атомов азота из разных аминокислот в молекулу мочевины:
- азот одной аминогруппы - в виде аммиака в матриксе митохондрии (*N);
- азот второй аминогруппы поставляется в составе аспартата в цитозоле (**N)
Аспартат, необходимый для синтеза аргининосукцината, образуется в печени:
• преимущественно с использованием аминогруппы аланина, который поступает из мышц и клеток кишечника (рис. 9.11);
• путем трансаминирования глутамата с оксалоацетатом. Образующийся в орнитиновом цикле фумарат включается в реакции
цитратного цикла и превращается в оксалоацетат, который путем трансаминирования снова образует аспартат (см. рис. 9.11). Таким образом, с орнитиновым циклом сопряжен цикл регенерации аспартата из фумарата. Пируват, образующийся в этом цикле, используется в ОПК или для глюконеогенеза.
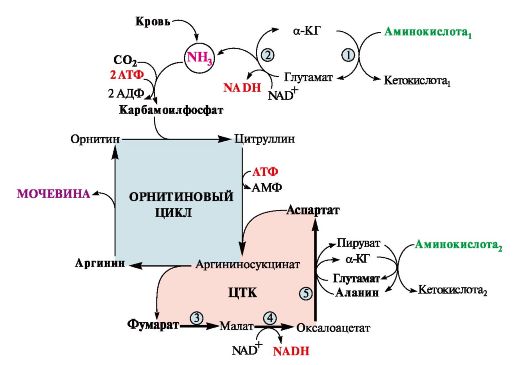 Рис. 9.11. Цикл регенерации аспартата.
Рис. 9.11. Цикл регенерации аспартата.
Ферменты, катализирующие реакции: 1 - аминотрансфераза; 2 - глутаматдегидрогеназа; 3 - фумараза; 4 - малатдегидрогеназа; 5 - аминотрансфераза
3. В орнитиновом цикле расходуется энергия четырех макроэргических связей трех молекул АТФ на синтез одной молекулы мочевины. Затраты энергии происходят также при трансмембранном переносе компонентов цикла (цитруллина, орнитина, мочевины) (см. рис. 9.10). В почках перенос мочевины из крови в мочу происходит за счет градиента ионов натрия, создаваемого К, Na-АТФазой, которая потребляет АТФ.
Процесс синтеза мочевины имеет возможность компенсации энергозатрат (см. рис. 9.11):
• при регенерации аспартата из фумарата на стадии дегидрирования малата образуется NADH, который может обеспечить синтез трех молекул АТФ;
• при окислительном дезаминировании глутамата в разных органах также образуется NADH, соответственно - еще три молекулы АТФ.
4. Орнитиновый цикл в печени выполняет две функции:
• превращение азота аминокислот в мочевину, которая экскретируется и помогает избежать накопления аммиака в организме;
• синтез аргинина и пополнение его фонда в организме.
Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Такой запас мощности необходим для предотвращения гипераммониемии при изменениях количества белка в пище.
5. Регуляторными реакциями являются синтез карбамоилфосфата, цитруллина и заключительная реакция, катализируемая аргиназой. Основным регуляторным фактором является содержание субстратов, прежде всего аммиака. Высокий уровень NH3 вызывает повышение уровня образования мочевины. Кроме того, скорость орнитинового цикла регулируется с помощью двух механизмов:
• аллостерическая активация карбамоилфосфатсинтетазы I N-ацетил- глутаматом (N-АГ);
• индукция синтеза ферментов карбамоилфосфатсинтетазы I, орнитинкарбамоилтрансферазы и аргиназы кортизолом.
N-ацетилглутамат является активатором карбамоилфосфатсинтетазы I. Образуется в матриксе митохондрий гепатоцитов из глутамата и ацетил-КоА специфической синтазой (рис. 9.12), которая активируется при повышении содержания аргинина в печени.
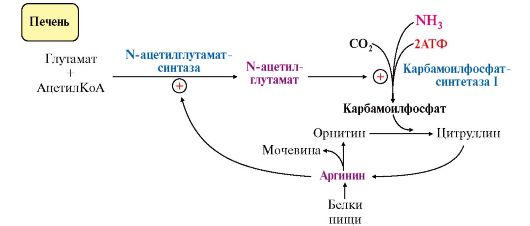 Рис. 9.12. Регуляция карбамоилфосфатсинтетазы I
Рис. 9.12. Регуляция карбамоилфосфатсинтетазы I
Индукция синтеза ферментов орнитинового цикла происходит в ответ на повышение скорости распада белков при голодании, длительной физической работе и при высокобелковой диете. В этих случаях углерод аминокислот превращается в глюкозу, а азот включается в молекулу мочевины. Индукция синтеза ферментов орнитинового цикла происходит параллельно с индукцией ферментов глюконеогенеза, АЛТ и глутаматдегидрогеназы. Заболевания, характеризующиеся интенсивным распадом белков тканей (сахарный диабет и др.), также сопровождаются активацией орнитинового цикла.
Дата добавления: 2015-09-01; просмотров: 389 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ТЕМА 9.4. ОБМЕН АММИАКА: ИСТОЧНИКИ, ПРЕВРАЩЕНИЕ В ТКАНЯХ | | | ТЕМА 9.6. ГИПЕРАММОНИЕМИЯ И ЕЕ ПРИЧИНЫ |