
Читайте также:
|
Этот эффект состоит в изменении температуры газа, продавливаемого сквозь пористую перегородку. Первоначальной целью опыта было выяснение того, в какой мере свойства реальных газов близки к свойствам идеального газа. В эксперименте Джоуля и Томсона использовалась трубка из теплоизолирующего материала с двумя поршнями и пробкой из пресованной ваты посредине (рис. 10).

|
С помощью поршней газ продавливался сквозь пробку таким образом, что в области I поддерживалось постоянное давление P 1, а в области II – давление P 2.
Работа, совершаемая над газом при продавливании сквозь пробку,
| – L | = | 
| |
| = | 
| (21) |
Первое слагаемое в правой части представляет работу, которую мы должны произвести, чтобы выдавить газ из области I, а второе – работу, которую производит газ, чтобы заполнить область II.
Применим к процессу Джоуля – Томсона первый закон термодинамики (1.7). Поскольку процесс происходит в отсутствие теплообмена, то Q = 0, и соотношение (1.7) принимает вид
| E 1– E 2 = – L = P 1 V 1– P 2 V 2. | (22) |
Отсюда следует, что
| E 1+ P 1 V 1 = E 2+ P 2 V 2, |
или
| W 1 = W 2. | (23) |
Таким образом, процесс Джоуля – Томсона происходит при постоянной энтальпии.
Авторы эксперимента обнаружили малые изменения температуры газов. Они установили, что при нормальных температурах и давлениях воздух после продавливания слегка охлаждается, а водород – нагревается. Эти температурные изменения имеют важное значение, и мы рассмотрим их подробнее.
Прежде всего отметим, что процесс Джоуля – Томсона является необратимым, поскольку перегородка с малыми отверстиями создает трение. Поэтому, хотя процесс происходит в отсутствие теплообмена ( ), энтропия газа при протекании через перегородку не сохраняется:
), энтропия газа при протекании через перегородку не сохраняется:  .
.
Выведем соотношение, связывающее изменения температуры в процессе с изменениями давления. Рассмотрим бесконечно малый процесс, при котором P и T изменяются на dP и dT. Поскольку энтальпия в процессе Джоуля – Томсона сохраняется, dW = 0, то из тождества

|
следует соотношение
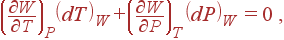
| (24) |
откуда

| (25) |
Эта величина называется коэффициентом Джоуля – Томсона.
Производную  нужно выразить через T, P и V. Это можно сделать, если заметить, что тождество (16) для W полностью аналогично термодинамическому тождеству (1.41) и может быть получено из (1.41) путем формальной замены
нужно выразить через T, P и V. Это можно сделать, если заметить, что тождество (16) для W полностью аналогично термодинамическому тождеству (1.41) и может быть получено из (1.41) путем формальной замены
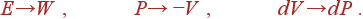
| (26) |
Из следовало соотношение (1.52). Производя замену (26) в (1.52), получаем
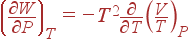
| (27) |
и, следовательно, коэффициент Джоуля – Томсона

| (28) |
Для идеального газа V / T = NR / P, так что
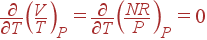
|
и, следовательно,
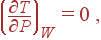
|
т.е. изменения температуры в процессе Джоуля – Томсона не происходит.
Для реальных газов коэффициент Джоуля – Томсона (28) может быть как положительным, так и отрицательным. Поскольку  отрицательно, то в первом случае температура понижается, а во втором – повышается. При нормальных температурах и давлениях для кислорода и азота реализуется первый случай, а для водорода и гелия – второй.
отрицательно, то в первом случае температура понижается, а во втором – повышается. При нормальных температурах и давлениях для кислорода и азота реализуется первый случай, а для водорода и гелия – второй.
Первый случай, когда температура газа при протекании через перегородку понижается, нашел широкое применение для охлаждения, сжижения и разделения газов. Поэтому представляет интерес исследовать на диаграмме (P, T) кривую инверсии, определяемую уравнением
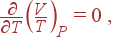
| (29) |
или

| (30) |
Эта кривая отделяет положительную область, где  , от отрицательной области, где
, от отрицательной области, где 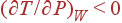 .
.
Дата добавления: 2015-09-02; просмотров: 110 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Энтальпия | | | Эффект Джоуля – Томсона для газа Ван-дер-Ваальса |