
Читайте также:
|

| Рис. 3.1. Трехмерная сетка, образованная системами параллельных линий – аналог кристаллической решетки |
Будем рассматривать простую кубическую, гранецентрированную кубическую (ГЦК), объемно центрированную кубическую (ОЦК) и гексагональную плотноупакованную (ГПУ) кристаллические решетки (рис. 3.2). Эти типы решеток самые распространенные среди металлов: ГЦК – алюминий, медь, серебро, золото, никель, платина и др.; ОЦК – железо (при температурах ниже 911 °С), хром, вольфрам, молибден и др.; ГПУ – бериллий, титан, кобальт, цирконий, цинк, олово, рений и др. Некоторые металлы при изменении температуры изменяют тип кристаллической решетки; подобное превращение называется полиморфным и имеет определенную температуру Тп.п. Полиморфное превращение сопровождается изменением энергии металла: либо поглощением, либо выделением теплоты в окружающую среду. Примерами подобных металлов являются железо, титан, кобальт и др.
Как известно, металлами называют кристаллические тела, имеющие на каждый атом кристалла один или несколько подвижных (свободных) электронов. Эти электроны объединяются в энергетическую зону (зону проводимости), средняя энергия электронов в которой меньше, чем энергия тех же электронов в изолированных друг от друга атомах. Разность энергий электронов проводимости в атоме и кристалле и является энергией металлической связи в кристаллической решетке.

Рис. 3.2. Простая кубическая (а), объемно центрированная (б),
гранецентрированная (в), кубические и гексагональная
плотноупакованная (г) решетки
Считается, что взаимодействие атомов (ионов) в кристаллической решетке парное, т. е. энергия взаимодействия всех атомов в кристалле есть сумма энергий взаимодействия всех пар атомов:
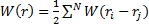 (3.1)
(3.1)
где W(r) – сумма взаимодействия всех пар; ri, и rj – координаты i-го и j-го атомов; W(ri – rj) – энергия их взаимодействия; N – число пар.
Если два иона в пространстве расположены на расстоянии r, то при их сближении они начинают притягиваться, причем энергия этого взаимодействия достигает минимума при r = r0 (рис. 3.3). Равновесное положение r0, около которого происходят тепловые колебания, находится из условия:
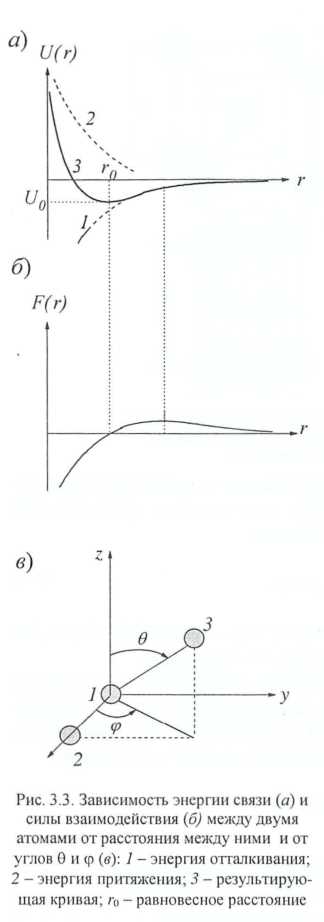
| Рис. 3.3. Зависимость энергии связи (а) и силы взаимодействия (б) между двумя атомами от расстояния между ними и от углов θ и φ (в): 1 – энергия отталкивания; 2 – энергия притяжения; 3 – регулирующая кривая; r0 – равновесное расстояние |
 (3.2)
(3.2)
где F(r) - сила.
Энергия в этом положении W(r0) называется энергией связи. Эта величина характеризует работу А, которую необходимо затратить, чтобы оторвать атомы друг от друга и удалить на такое расстояние, на котором их взаимодействие не ощущается, А+W(r0) = 0. Очевидно, что для стабильности кристалла необходимо условие А > 0, т. е. W(r0) < 0, и кристаллическое состояние атомов энергетически выгодно.
Энергия притяжения, например, в системе ион-электрон, которая является первопричиной металлической связи, ощущается при всех значениях r. Энергия отталкивания (кривая 2 на рис. 3.3) связана обычно с деформацией электронных оболочек ионов и ощущается лишь на малых радиусах взаимодействия r ≤ dат (dат – диаметр атома).
Атомные связи различаются в основном по характеру сил притяжения. Как известно, выделяют ионную, металлическую, ковалентную и молекулярную (ван-дер-ваальсову) связи. Эти взаимодействия характеризуются:
радиусом действия R (R >> r 0 – дальнодействуюшие, R ≈ r 0 – короткодействующие);
зависимостью от углов: если W = W (r), то взаимодействия называют центральными, поскольку они не зависят от углов, под которыми взаимодействуют ионы; если W= W (r, θ, φ) – нецентральными взаимодействиями, энергия которых зависит от углов θ и φ (см. рис. 3.3, 6); энергией связи: W0 > 1 эВ – сильная связь; W0 < 1 эВ – слабая связь; W0 ≈ 1 эВ – связь промежуточной силы.
На сегодняшний день наивысшую прочность имеют очень тонкие нитевидные кристаллы, получаемые конденсацией из пересыщенных растворов, газовой или плазменной фаз, – для их разрушения необходимо приложить напряжения до 10 ГПа, т. е. по прочности они приближаются к теоретической прочности τ °.
Так в чем же причина огромной разницы между прочностями идеального кристалла и реальных металлов? Ответ на этот вопрос дали исследования, которые начали проводить в 30-х гг. XX столетия, когда были высказаны гипотезы о роли дефектов кристаллического строения в формировании прочностных свойств металлов и механизмах пластической деформации. О каких дефектах шла речь?
Дата добавления: 2015-09-05; просмотров: 110 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ИСПЫТАНИЕ МЕТАЛЛОВ НА РАСТЯЖЕНИЕ | | | ТИПЫ ДЕФЕКТОВ КРИСТАЛЛИЧЕСКОГО СТРОЕНИЯ И ИХ ОСНОВНЫЕ СВОЙСТВА |