
Читайте также:
|
Как указывалось в § 1.3, главное в порядке – закономерность, предсказуемость физических явлений и процессов. Отсюда очевидно, что количественная оценка порядка должна быть связана с числами, позволяющими установить степень такой предсказуемости. В математике такие числа именуются вероятностью. Ясно, что чем больше вероятность того или иного события, тем больше порядка. И наоборот.
Однако непосредственной мерой порядка вероятность в том виде, в котором они введена в соответствующем разделе математики [8, 9, 10], быть не может. Дело в том, что она неточно учитывает динамику изменения порядка в процессах, в которых порядок не постоянен. Приведем такой простой пример. Студент, вернувшись после занятий домой, обнаруживает, что в его комнате беспорядок: не убрана постель. Он убирает постель и устанавливает порядок. Вернувшись на следующий день, обнаруживает вновь беспорядок в своей комнате. Однако на сей раз не только не убрана постель, но и не помыта посуда. Он затрачивает те же усилия, что и накануне, – убирает постель, но порядок не восстанавливает. Мы столкнулись с ситуацией, когда одно и то же изменение беспорядка привело к различному результату. Переводя на язык математики – язык количественных характеристик, – следует признать, что повышая вероятность какого-либо события на одну и ту же величину, мы получаем разный итоговый порядок в зависимости от исходной вероятности этого события. Следовательно, мера порядка I должна определяться не непосредственно, а через свое изменение Δ I:
 (1.8)
(1.8)
где р – исходная вероятность указанного события.
Получается – мерой порядка является такая величина, изменение которой равно отношению изменения вероятности к исходной вероятности.
Из формулы (1.8) следует (после интегрирования):
I = lnp. (1.8,а)
Иногда удобства ради перед знаком натурального логарифма ставят пересчетный коэффициент:
I = a lnp. (1.8,б)
Ясно, что качественно появление такого коэффициента ничего не меняет, однако процесс расчета становится более удобным. Тем более, что его можно выбрать самым разнообразным [9]:
а=1; тогда единица измерения [нат];
а=1/ln2⇒[бит];
а=1/ln8⇒[байт];
а=2-10/ln8=1/1024•ln8⇒[килобайт];
а=2-20/ln8⇒[мегабайт];
а=2-30/ln8⇒[гигабайт];
а=КБ=1,38∙10-23⇒[Дж/0К].
Коэффициент КБ именуется постоянной Больцмана и чаще всего вводится в формулу (1.8,б) в термодинамике.
Величина I именуется информацией [14, 15, 16, 52].
Следует отметить, что поскольку вероятность 0<р≤1, то информация согласно (1.8,б) есть величина отрицательная. Её можно заменить на противоположную по знаку величину S:
S = -I = a ln  = a lnР, (1.8,б)
= a lnР, (1.8,б)
где Р в теории вероятности именуется статистическим весом события (числом возможных вариантов его завершения).
Величина S именуется энтропией [1, 6, 8, 14, 16, 44].
Появление двух терминов, характеризующих по сути дела, одно и то же физическое понятие, носит чисто исторический характер. Иногда считают, что энтропия – это мера хаоса, а информация – мера порядка. При этом принимается в расчет, что с ростом энтропии порядок уменьшается, а хаос увеличивается, а рост информации приводит к прямо противоположному результату. Однако ясно, что подобное различие легко снимается простыми приёмами алгебры вещественных чисел.
Гораздо более существенным является отнесение термина “энтропия” только к одному разделу науки – термодинамике. Именно здесь этот термин и возник.
Дело в том, что термодинамика изучает процессы, которые весьма близки к идеальной (или предельной) модели хаоса. Такой моделью является множество одинаковых хаотически двигающихся шариков (корпускул). Эти шарики в рамках этой модели взаимодействуют друг с другом только путем упругого соударения. Такая модель именуется “идеальный газ” [44].
Казалось бы, вероятность обнаружить в идеальном газе какую-то конкретную частицу практически равна нулю – трудно придумать какую-нибудь величину, с помощью которой их можно различать друг от друга. Однако более тщательный анализ показывает, что это не так. Дело в том, что процентное содержание частиц, обладающих конкретной кинетической энергией, определяется строго детерминированной зависимостью – распределением Больцмана-Максвелла [44]. Таким образом, если бы удалось придумать прибор, улавливающий частицы в миллиардные доли секунды, и задать величину её кинетической энергии, как характерный признак, то число частиц, из которых этот прибор будет её выбирать, значительно меньше общего количества частиц в заданном объёме.
Главным параметром, позволяющим производить такой отбор, является температура. В модели “идеальный газ” под температурой подразумевается средняя кинетическая энергия хаотического движения корпускул. Чем выше температура, тем более равномерно распределяется между частицами кинетическая энергия и тем меньше вероятность обнаружения частицы по этому признаку.
На рис. 1.2 дано семейство зависимостей вероятности обнаружения частиц с определённой кинетической энергией от самой этой энергии, рассчитанное по формуле Больцмана – Максвелла [44].
Эта зависимость имеет максимум при величине кинетической энергии, соответствующей температуре. Причем, чем выше температура, тем меньше этот максимум. Следовательно, вероятность обнаружения частиц с заданной средней кинетической энергией обратно пропорциональна температуре. Принимая эту вероятность за основу характеристики порядка, можно записать
 (1.9,а)
(1.9,а)
где Т - температура идеального газа, А – коэффициент пропорциональности.
Сопоставляя (1.9,а) с (1.8), получаем
 (1.9,б)
(1.9,б)
| p |
| Т1 < T2 <Т3 ТТT3 |
wк.п.д.
Рисунок 1.2.
Семейство зависимостей вероятности обнаружения частиц от кинетической энергии хаотического движения частиц:  - средняя кинетическая энергия хаотического движения молекул.
- средняя кинетическая энергия хаотического движения молекул.
Обычно коэффициент b принимают равным теплоемкости газа, т.е. коэффициенту пропорциональности между тепловой энергией (суммарной энергией хаотического движения частиц) и температурой. Тогда изменение энтропии записывается в виде
 (1.9,в)
(1.9,в)
Именно в этом виде энтропия используется в термодинамике.
Материал этого параграфа был бы неполным без того, чтобы в мерах энтропии определить понятие закономерности.
Рассмотрим какое-нибудь явление природы, например, вращение Земли вокруг Солнца. Интуитивно, или точнее, на основании ранее приобретенных знаний, каждый из нас полагает, что это вращение происходит по замкнутой траектории, весьма близкой к окружности. Эта траектория ежегодно повторяется. Все это так, но с определенной степенью точности. Влияние других планет, метеоритов, космических лучей, процессов на Солнце приводит к тому, что эта траектория соблюдается каждый год с определенной погрешностью. Отклонение от этой средней траектории характеризует степень хаотичности (энтропию) движения Земли. Если расширить это рассмотрение, то нетрудно заметить, что в случае полного хаоса Земля вообще могла летать в космосе по многочисленному количеству самых разнообразных траекторий. В этом случае её энтропия была бы максимальной. Но на самом деле она выбрала лишь чрезвычайно узкую трубку в пространстве вокруг окружности радиусом Rз = 150 млн. км, центр которой совпадает с центром Солнца. Если отложить по оси абсцисс расстояние от центра Солнца, а по оси ординат - вероятность нахождения Земли
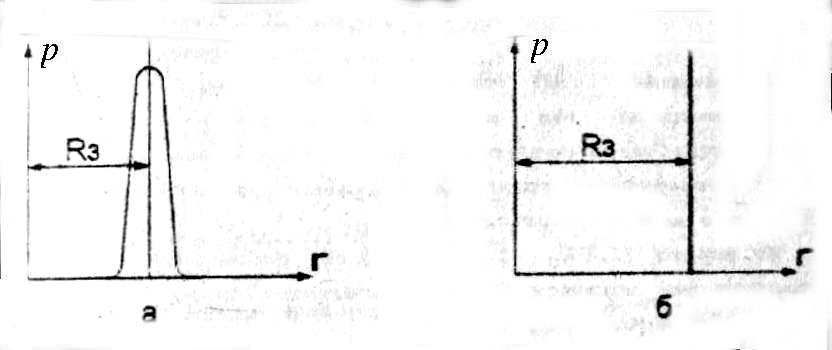
Рисунок 1.3.
Вероятность удаления Земли от Солнца: а – иллюстративная зависимость; б- фактическая зависимость.
рз, то, пренебрегая масштабами, получаем график, данный на рисунке 1.3,а. (Rз – средний радиус орбиты Земли). На самом деле точен рисунок 1.3,б, но неудобен, так как в пределах точности чертежа ничем не отличается от строго детерминированного. Вероятность этой траектории равна практически нулю.
Следовательно, энтропия закономерности отрицательна и устремляется в бесконечность. Информация же, наоборот, положительна.
Дата добавления: 2015-08-27; просмотров: 73 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Что такое масса и энергия? | | | Что такое синергия? Взаимосвязь энергетических (материальных) и информационных процессов |