
Читайте также:
|
Для количественного определения нами был выбран спектрофотометрический метод, как наиболее доступный в лабораторных условиях. Метод основан на измерении светопоглощения окрашенных комплексов с различными реагентами.
Растворы каптоприла и 1,10-фенантролина бесцветны, раствор соли меди при фотометрической концентрации имеет слабо-голубое окрашивание, близкое к бесцветному. Растворы двойных систем Cu-каптоприл, Cu(II)-Phen бесцветны,а система Phen- каптоприл имеет светло-жёлтую окраску. Спектры двойных систем представлены на рисунке 12425

Рис. 2.1. Спектры поглощения растворов:
1 – каптоприл-Phen; 2 – каптоприл-медь; 3 – Phen-медь; Сф(Cu2+) =10-3 моль/л, Сф (Phen) = 10-3 моль/л, Сф(каптоприл) = 10-3 моль/л; λ=400 нм, l=0,3 см., ПЭ5400В.
Раствор, содержащий медь, 1,10-фенантролин и каптоприл, окрашен в желто-оранжевый цвет в зависимости от рН раствора.
Для определения устойчивости и оптимальных условий комплексообразования необходимо было выбрать оптимальное рН раствора. Для этого приготовили аммиачные буферные растворы от 3 до 9. В кислой среде (рН=3-6) растворы окрашены в оранжевый цвет, практически мгновенно происходит обесцвечивание окрашенного раствора через 2 минуты после сливания реагентов. При рН=7-9 появляется желто-оранжевое окрашивание, на открытом воздухе растворы начинали сверху обесцвечиваться.
Спектры растворов снимали по истечении 10 минут и после 5 перемешиваний. Кювету с раствором сверху накрывали стеклом для предотвращения окисления получаемой системы кислородом воздуха.
Зависимость оптической плотности от рН показана на рис.2.1.

Рис. 2.1. Влияние рН на светопоглощение в растворе медь-1,10-фенантролин-каптоприл; Сф(Cu2+) =10-3 моль/л, Сф (Phen) = 2∙10-3 моль/л, Сф(каптоприл) =4∙10-3 моль/л; λ=400 нм, l=0,3 см., ПЭ5400В.
Таким образом, нами установлено, что оптимальной средой для образования системы медь(I)-1,10-фенантролин при наличии каптоприла является рН=7, так как светопоглощение при этой кислотности происходит максимальное, и находится в области λ=400нм.
2.2.2 Влияние стабилизаторов на устойчивость комплекса во времени
В ходе исследования оптимального рН раствора было замечено, что растворы обесцвечиваются под влиянием кислорода воздуха, тогда как при отсутствии доступа кислорода окраска растворов сохранялась продолжительное время.
Известно, что аскорбиновая кислота превосходит другие антиоксиданты плазмы крови в защите липидов от перекисного окисления. Антиоксдантные свойства аскорбиновой кислоты связаны с ее оксиредуктазными переходами и характеризуются широким спектром инактивирующего действия на различные свободные радикалы. Теряя атом водорода, аскорбиновая кислота превращается в радикал - монодегидроаскорбиновую кислоту, проявляющую прооксидантный эффект, потеря еще одного атома H+ приводит к образованию дегидроаскорбиновой кислоты.
Наиболее характерным свойством аскорбиновой кислоты является ее способность давать химически и термодинамически обратимую окислительно-восстановительную систему; с этим свойством обычно связывают ее физиологическую функцию.
Водные растворы L-аскорбиновой кислоты бесцветны и не поглощают в видимой области спектра, но при нейтральных значениях рН в спектре поглощения наблюдается сильный сигнал при 265 нм.
Для проверки влияния стабилизатора на процессы, протекающие в растворе, мы исследовали действие аскорбиновой кислоты (рис.2.2). Для этого мы смешали исследуемые компоненты с добавлением ацетато-аммонийного буферного раствора с рН7, перемешали до однородности, измерили оптическую плотность, далее раствор из кюветы долили к общему раствору и дали раствору постоять минуту. Спустя 1 минуту вновь перемешали и измерили оптическую плотность.

Рис. 2.2. Влияние аскорбиновой кислоты на спектр поглощения: Сu-1,10-фенантролин-каптоприл. Сф(Сu2+) = 10-3 моль/л, Сф(Phen) = 10-3 моль/л, Сф(капт) = 10-3 моль/л, λ=400нм, рН=7, l=0,3 см., ПЭ 5400В
1 - Без стабилизатора 2 - В присутствии Сф(H2Аsc) = 10-3 моль/л;.
Из полученных результатов сделали вывод, что присутствие аскорбиновой кислоты предотвращает окисление в исследуемой системе. Стабилизация окраски раствора происходит в течение 5-6 минут, в дальнейшем значения оптической плотности измеряли по истечении 10 минут. Конечный порядок сливания компонентов: каптоприл-1,10-фенантролин-Cu(II)-аскорбиновая кислота - буферный раствор.
2.3. Определение оптимального количества каптоприла для образования [Cu(Phen)2]+
Для определения требуемой концентрации каптоприла для образования в растворе комплексного иона [Cu(Phen)2]+ используем метод молярных отношений (метод «насыщения»). Сущность метода заключается в установлении зависимости оптической плотности от концентрации одного из компонентов при постоянной концентрации второго компонента.
Для установления эквивалентного количества каптоприла в процессе образования комплекса [Cu(Phen)2]+ в среде ацетато-аммонийного буферного раствора, с начала постоянной принимали фотометрируемую концентрацию Phen, равную 10-3 моль/л, значение которой превышает в 2 раза фотометрируемую концентрацию образуемого в растворе исследуемого комплекса. За переменную концентрацию добавляемого компонента приняли концентрации лекарственного компонента (каптоприла) и меди, в молярном соотношении С(каптоприл)/С(Cu2+) от 9:1 до 1:9. Приготовленные растворы фотометрировали при длине волны λ=400 нм. График зависимости оптической плотности от соотношения объемов компонентов представлен на рис.2.3.
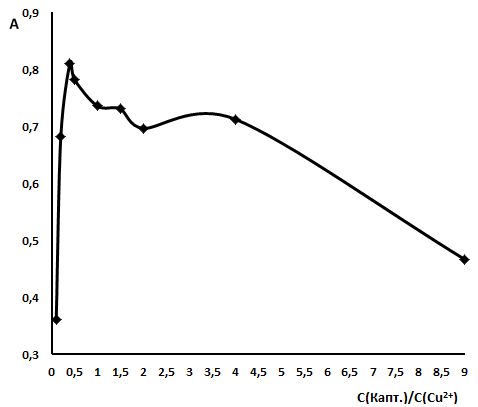
Рис.2.3. Метод молярных отношений для системы: капт - Cu2+
Сф(Cu2+) = 10-3 моль/л, Сф(Phen) = 10-3 моль/л Сф(H2Аsc) = 10-3 моль/л; рН=7 (ацетато-аммонийный буферный раствор), l=0,3 см, ПЭ5400В.
Исходя из полученных данных, делаем вывод, что для полного образования комплекса [Cu(Phen)2]+ требуется 2 кратный избыток тиола в системе по отношению к исходному количеству ионов Cu2+ в растворе.
Затем проверяли оптимальное соотношение меди и фенантролина в данной системе для активации и полноты протекания реакции. Для этого в среде ацетато-аммонийного буферного раствора, постоянным принимали установленное ранее соотношение С(Капт.)/С(Cu2+). За переменную концентрацию добавляемого компонента приняли концентрацию лекарственного компонента (фенантролина), в молярном соотношении С(Phen)/С(Cu2+) от 9:1 до 1:9. Приготовленные растворы фотометрировали при длине волны λ=400 нм. График зависимости оптической плотности от соотношения объемов компонентов представлен на рис.2.3. 
Рис.2.3. Метод молярных отношений для системы: Phen - Cu2+
Сф(Cu2+) = 10-3 моль/л, Сф(Phen) = 10-3 моль/л Сф(H2Аsc) = 10-3 моль/л; рН=7 (ацетато-аммонийный буферный раствор), l=0,3 см, ПЭ5400В.
2.5. Изучение образования [Cu(Phen)2]+ в присутствии ацетилцистеина в среде калий-фосфатного буферного раствора
Химические процессы, протекающие в тканях организма, требуют наличия ряда условий, среди которых важное значение имеет рН среды. Благодаря действию буферных систем, поддерживается относительное постоянство водородного показателя внутренней среды, обеспечивающее полноценность метаболических процессов.
В литературных данных описывается изучение процесса образования медь-1,10-фенантролинатного комплекса и его воздействия на ДНК в 0,1 М трис-ацетатном буфере (рН 7.0) и 5 мМ ацетата магния [2]. Трис (трис(гидроксиметил)аминометан) широко используется в биохимии и молекулярной биологии в качестве буферного раствора, например, в буферных системах TAE и TBE, для растворения нуклеиновых кислот. Вместе с тем известно, что трис является гасителем ОН · - радикалов, поэтому некоторые авторы [17-19] предлагают проводить данную реакцию другом буфере, скажем 20 мМ натрий-фосфатном (рН 7.5). Интересная особенность фосфатного буфера состоит в том, что оба его компонента являются сильными электролитами, но в то же время этот буфер удовлетворяет требованиям, предъявляемым к буферным системам, состоящим из слабых кислот и их солей с сильным основанием. Механизм действия фосфатного буфера аналогичен действию ацетатного буфера.
На основе литературных данных провели исследование образования исследуемого комплекса в присутствии каптоприла в среде калий-фосфатного буферного раствора с рН7, полученного смешиванием 1М растворов солей KH2PO4 и K2HPO4 в определенных объемных отношениях.

Рис. 2.5. Спектры поглощения растворов исследуемой системы в присутствии 1- фосфатного и 2 - ацетато-аммонийного буферных растворов
На рис.2.5 видно, что изменение буферного раствора не влияет на основной максимум поглощения раствора, наблюдаемый при λ=400нм.
2.6. Исследование влияния кислотного остатка соли меди (II) на образование комплекса [Cu(Phen)2]+
Для проведения данного исследования был приготовлен раствор CuSO4 концентрацией 10-3. Измерили спектры поглощения систем с сульфатом меди и двухводным хлоридом меди. Графическая зависимость оптической плотности от длины волны показана на рисунке «№;%:?

Рис.!»№;%:?*Влияние внешней сферы комплекса [Cu(Phen)2]+на его активность:Сф(CuSO4) = 10-3 моль/л, Сф(Phen) = 10-3 моль/л Сф(H2Аsc) = 10-3 моль/л; рН=7 (ацетато-аммонийный буферный раствор), l=0,3 см, ПЭ5400В.

Рис. 2345 Влияние внешней сферы комплекса [Cu(Phen)2]+на его активность: Сф(CuCl2 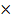 2H2O) = 10-3 моль/л, Сф(Phen) = 10-3 моль/л Сф(H2Аsc) = 10-3 моль/л; рН=7 (ацетато-аммонийный буферный раствор), l=0,3 см, ПЭ5400В.
2H2O) = 10-3 моль/л, Сф(Phen) = 10-3 моль/л Сф(H2Аsc) = 10-3 моль/л; рН=7 (ацетато-аммонийный буферный раствор), l=0,3 см, ПЭ5400В.
Для наглядности полученных результатов совместили два графика (рис. 234 и рис. 2345), и проследили характер влияния внешней сферы комплекса на его активность:

Рис. 234 Спектры поглощения растворов исследуемой системы в присутствии 1- CuCl2 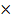 2H2O и 2 - CuSO4
2H2O и 2 - CuSO4
Из рисунка 234видно, что изменение кислотного остатка соли меди не влияет на основной максимум поглощения раствора, наблюдаемый при λ=400нм
Дата добавления: 2015-08-17; просмотров: 118 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Материалы и аппаратура | | | Исследование полноты восстановления меди (II) до меди (I) |