
Количественное определение метионина также проводят йодометрически способом обратного титрования. В среде фосфатного буферного раствора метионин окисляется до сульфоксида:
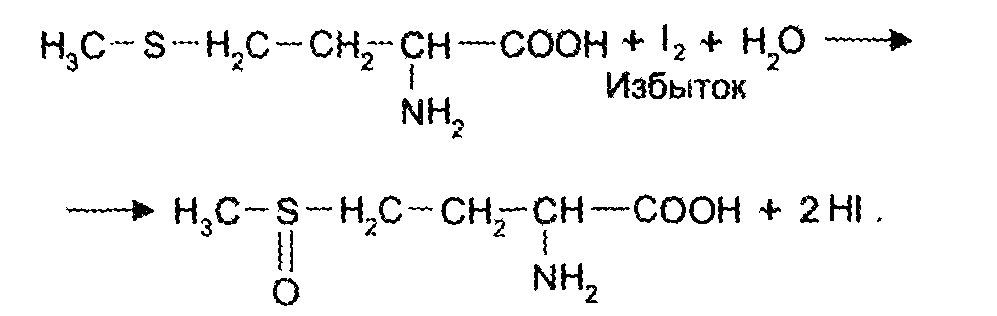
Избыток йода оттитровывают стандартным раствором тиосульфата натрия.
1.1.3. Лекарственные средства – производные пирролидина и их биологическая роль
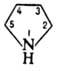 Пирролидин (азолидин, тетрагидропиррол, тетраметиленимин) — органическое соединение классагетероциклов, имеющее брутто формулу C4H9N. Прозрачная жидкость с аммиачным запахом, дымит на воздухе. Его можно рассматривать как циклическийамин с четырьмя атомами углерода в цикле. Хорошо растворим в воде и большинстве органических растворителей; сильное основание, рКа=11,27. С кислотами образует соли: гидрохлорид, пикрат.
Пирролидин (азолидин, тетрагидропиррол, тетраметиленимин) — органическое соединение классагетероциклов, имеющее брутто формулу C4H9N. Прозрачная жидкость с аммиачным запахом, дымит на воздухе. Его можно рассматривать как циклическийамин с четырьмя атомами углерода в цикле. Хорошо растворим в воде и большинстве органических растворителей; сильное основание, рКа=11,27. С кислотами образует соли: гидрохлорид, пикрат.
Пирролидин обладает свойствами вторичных аминов, например легко алкилируется в положение 1 при действии алкилгалогенидов и спиртов, взаимодействует с акрилонитрилом и формальдегидом, в качестве аминной компоненты вступает в реакцию Манниха:

Получают пирролидин каталитическим гидрированием пиррола или 3-пирролина, восстановлением сукцинимида, аммонолизом 1,4-дигалогенбутанов или тетрагидрофурана, пиролизом гидрохлорида 1,4-тетраметилендиамина (путресцина) или циклизацией 1-амино-4-галогенбутанов под действием щелочи, например:

N-Алкилзамещенные пирролидина получают алкилированием пирролидина или циклизацией N-галогенопроизводных вторичных алифатических аминов по Гофмана-Лёфлера реакции. В лабараторной практике пирролидин применяют для синтеза енаминов, используемых в качестве промежуточных соединений при α-алкилировании и α-ацилировании кетонов по Сторку, например:

Кольцо пирролидина-структурный фрагмент многих биологически активных соединений, например никотина, алкалоидов группы тропана (атропина, кокаина, экгонина и других), алкалоида гигрина; в небольших количествах пирролидин содержится в листьях табака и в опии. Важнейшие производные пирролидина - пролин, 2-пирролидон, 1-винил-2-пирролидон, сукцинимид. Пирролидин возбуждает центральную нервную систему, снижает (при длительном воздействии) содержание гемоглобина в крови, усиливает диурез. ЛД50 0,3 г/кг (белые крысы, перорально); ПДК 0,1 мг/м3. Пирролидин и его производные-сырье для синтеза некоторых лекарственных средств.
Источник: http://www.xumuk.ru/encyklopedia/2/3368.html
Производные пирролидина – каптоприл и эналаприл
В 80-х годах XX века были созданы синтетические ингибиторы ангиотензинконвертирующего фермента, обладающие антигипертензивным действием. Наиболее широкое применение из них сразу же получили производные пирролидина: каптоприл и эналаприл.
Основной химической структуры каптоприла и эналаприла является производное аминокислоты пролина – 2-метилпропионил-L-пролин:

| Рис. 2 |
Каптоприл- первый синтетический серосодержащий ингибитор ангиотензинконвертирующего фермента, основной представитель этой группы. Эналаприл отличается от каптоприла более сложной химической структурой и отсутствием в молекуле меркапто-группы (таблица 1). Он является «пролекарством», так как в организме гидролизуется до каптоприла, ингибирующего ангиотензинконвертирующий фермент.
Исходными продуктами синтеза каптоприла являются тиоуксусная и метакриловая кислоты. Они образуют тиоэфир, который превращают в хлорангидрид, или ацилируют пролин и полученное N-ацилпроизводное гидролизуют: 

Производные пролина представляют собой белые кристаллические вещества (табл. 2). Каптоприл легко растворим в воде, этаноле, метаноле, хлороформе. Эналаприл умеренно растворим в воде, растворим в этаноле, метаноле и диметилформамиде.
Фармакопея США рекомендует для испытания их подлинности использовать ИК-спектры, которые должны соответствовать спектрам стандартных образцов.
Каптоприл и эналаприл идентифицируют методом ВЭЖХ по временам удерживания основных пиков. Каптоприл идентифицируют также методом ТСХ на пластинках Силуфол или Сорбфил УФ-254 параллельно со свидетелем в системе толуол - ледяная уксусная кислота (3:1). Методом ВЭЖХ определяют примесь каптоприла дисульфида (по параметрам пиков примеси и испытуемого вещества).
Каптоприл можно йодаметрическим методом определить количественно. Точную навеску (около 0,3 г) растворяют в 100 мл воды в колбе с притёртой пробкой, добавляют 10 мл 3,6 М серной кислоты и 1 г йодида калия, 2 мл раствора крахмала. Титруют 0,1 М раствором йодата калия до появления голубой окраски, не исчезающей в течение 30 сек. Определение основано на окислении сульфгидрильной группы йодом:


Количественное определение каптоприла в таблетках выполняют методом УФ-спектрометрии при длине волны 212 нм (растворитель 0,1 М раствор хлороводородной кислоты). Эналаприла малеат в таблетках определяют методом ВЭЖХ. (Беликов)
Определение подлинности эналаприла и каптоприла:
1. ИК-спектры каптоприла и эналаприла должны соответствовать спектрам соответствующих стандартных образцов (Фармакопея США).
Характеристические полосы в ИК-спектре каптоприла: 1742, 1589, 1245, 1229, 1202, 1192 см-1
2. Оба препарата в пирролидиновом кольце имеют хиральный центр (С-2) и являются левовращающими изомерами. Удельное вращение каптоприла [а] от -125° до -134° (с 1,0%; абс. этанол).
3. УФ-спектр каптоприла имеет 1 слабо выраженный максимум, который не применим для количественного определения (215 нм). В УФ-спектре этанольного раствора эналаприла малеата наблюдается 1 максимум с длиной волны 260 нм (ароматическое кольцо).
4. Каптоприл и эналаприл идентифицируют методом ВЭЖХ по временам удерживания основных пиков.
5. Третичный атом азота определяют с привлечением общих осадительных реактивов на алкалоиды.
6. Карбоксамидную (каптоприл) и сложноэфирную связь (эналаприла малеат) обнаруживают гидроксамовой пробой.
7. Меркаптогруппу (SН) в каптоприле переводят в ионогенное состояние и обнаруживают реакцией с нитропруссидом натрия.
8. SН-группа в каптоприле обесцвечивает раствор йода (применяют для количественного определения).
9. Каптоприл идентифицируют методом хроматографии в тонком слое (ТСХ) на пластинках «Силуфол» или «Сорбфил» УФ- 254 в системе растворителей толуол - ледяная уксусная кислота (3:1).
10. После щелочного гидролиза эналаприла выделяется этанол, который подтверждают йодоформной пробой.
11. Нингидриновая проба за счет наличия аланина в эналаприле (сине-фиолетовое окрашивание)
12. На двойную связь в малеиновой кислоте:
а)с калия перманганатом в кислой среде - обесцвечивание.
б)обесцвечивание бромной воды с образованием дибромянтарной кислоты, которую определяют по т. пл.
Количественное определение.
1. Содержание каптоприла определяют методом йодатометрии, основанном на окислении меркаптогруппы йодом:
Титрант - калия йодат, индикатор - крахмал.
2. Количественное определение каптоприла (таблетки) выполняют методом УФ-спектрофотометрии при длине волны 212 нм (растворитель 0,1 моль/л раствор хлороводородной кислоты); эналаприла малеата - при длине волны 260 нм.
3. Эналаприла малеат определяют алкалиметрически по малеиновой кислоте (индикатор фенолфталеин).
Форма выпуска. Каптоприл - таблетки по 0,025; 0,05 и 0,1 г, эналаприл - по 0,005, 0,01 и 0,02 г. Хранение. По списку Б, в сухом, защищенном от света месте в плотно укупоренной таре, каптоприл - при температуре не выше 30°С. Применение: Каптоприл - первый синтетический ингибитор ангиотензинконвертирующего фермента (АПФ). Назначают каптоприл для лечения гипертонической болезни и застойной сердечной недостаточности.
Эналаприл является «пролекарством», так как в организме он гидролизуется с образованием эналаприлата, являющегося ингибитором АПФ.
http://otherreferats.allbest.ru/medicine/00190797_0.html
Производное пирролидина – каптоприл
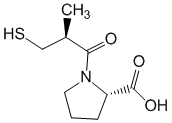
Химическое название:1-[(2S)-3-Меркапто-2-метилпропионил]-L-пролин.
Фармакотерапевтическая группа: антигипертензивный препарат. Фармакологическое действие
Каптоприл первый из нового класса антигипертензивных препаратов, который конкурентно блокирует ангиотензин I, преобразующий фермент (ACE), фермент, ответственный за преобразование ангиотензина Iв фермент, ответственный за преобразование ангиотензина Iв ангиотензин II.
Каптоприл предотвращает превращение ангиотензина Iв ангиотензин II, блокируя ангиотензинпревышающий фермент, пептидилдипептил углеродную гидролазу.
Результатом этого является снижение в плазме ангитензина IIи повышение активности в плазме ренина (PRA) из-за утраты отрицательной обратной связи на образование ренина, вызванной снижением ангиотензина II. Снижение ангиотензина IIведет к сокращению секреции альдостерона и, как результат, небольшое повышение содержания сывороточного калия может произойти наряду с потерей натрия и жидкости.
Применение каптоприла вызывает снижение тонуса артериол и венозных сосудов, снижает общее периферическое сосудистое сопротивление, уменьшает постнагрузку на сердце, снижает АД. Уменьшает преднагрузку, снижает давление в правом предсердии и в малом круге кровообращения.
Снижение кровяного давления обычно достигает максимума через 60-90 минут после орального принятия каптоприла. Длительность действия зависит от дозы. Снижение кровяного давления может быть постепенным, и чтобы достичь максимального терапевтического эффекта могут потребоваться несколько недель терапии.
Кровяное давление понижается примерно одинаково как в вертикальной, так и в горизонтальной позициях. Ортостатический эффект и тахикардия редки, но случаются у пациентов со сниженной массой тела, Прекращение приема каптоприла не ассоциируется с быстрым повышением кровяного давления.
Мr=217,2
Содержит не менее 98,0% и не более 101,5% каптоприла в перерасчете на сухое вещество.
Описание. Белый или почти белый кристаллический порошок.
Растворимость. Легко растворим в воде, метиленхлориде и метаноле.
Прозрачность раствора. Раствор 0,2г субстанции в 10 мл воды должен быть прозрачным или выдерживать сравнение с эталоном I.
Цветность раствора. Раствор, полученный в испытании на прозрачность раствора, должен быть бесцветным или выдерживать сравнение с эталоном В9.
pH. От 2,0 до 2,6 (2% раствор).
Посторонние примеси. Определение проводят по методу ВЭЖХ.
Испытуемый раствор.0,05 г субстанции растворяют в 100 мл подвижной фазы (ПФ).
Раствор сравнения. 2 мл испытуемого раствора помещают в мерную колбу (100 мл), доводят объемом раствора ПФ до метки и перемешивают.
Раствор для проверки пригодности системы. 0,01 г субстанции растворяют в 100 мл ПФ и прибавляют 1 мл 0,05 М йода. 1мл полученного раствора разводят ПФ до 10 мл.
Хроматографируют раствор для проверки пригодности системы. На хроматограмме должно наблюдаться 3 пика. Порядок элюирования пиков: калия йодид, каптоприла дисульфид. Разрешение (R) между пиками каптоприла и каптоприла дисульфида должно быть не менее 2,0.
Потеря в массе при высушивании. Около 1 г (точная навеска) субстанции сушат при остаточном давлении 5 мм рт. ст. и при температуре 60 0С в течение 3ч. Потеря в массе не должна превышать 1,0 %.
Сульфатная зола и тяжелые металлы. Сульфатная зола из 0,5 г субстанции не должна превышать 0,2 % и должна выдерживать испытания на тяжелые металлы (не более 0,002 % в субстанции).
Количественное определение. Около 0,3 г субстанции растворяют в 100 мл воды, прибавляют 10 мл серной кислоты разведенной 16 %,1 г калия йодида и титруют 0,0167 М раствором калия йодида до появления слабо - голубого окрашивания, не исчезающего в течении 30 с (индикатор - 2мл раствора крахмала).
http://www.bibliofond.ru/view.aspx?id=703911
Получение каптоприла
Каптоприл получают следующими путями: при первом способе - прямым ацилированием L-пролина хлорангидридом 3-ацетилтио-2 очередь получают взаимодействием метакриловой и тиоуксусной кислот. Образовавшийся в результате взаимодействия L- пролина с хлорангидридом 3-ацетилтио-2-метилпропионовой кислоты 1-(3-ацетилтио-2-D-метилпропаноил)-L-пролин далее подвергают аммонолизу с получением искомого каптоприла.
Второй способ отличается от первого лишь тем, что ацилированию хлорангидридом 3-ацетилтио-2-метилпропионовой кислоты подвергают предварительно защищенный по карбоксильной группе L-прлин - трет-бутиловый эфир L-пролина. Последний получают по следующей схеме: L-пролин ацилируют хлорбензилрвым эфиром с получением N- бензилоксикарбонил L-пролина. Восстановлением последнего водородом с использованием в качестве катализатора палладия на угле получают трет-бутиловый эфир L-пролина. После ацилирования последнего хлорангидридом получают трет-бутиловый эфир 1-(3-ацетилтио-2-метил-пропаноил) -L-пролина,из которого последовательно удаляются защитные группы. С помощью трифторуксусной кислоты гидролизуется сложноэфирная часть молекулы с получением 1-(3-ацетилтио-2-метилпропаноил)-L-пролина, из диастереомеров которого после разделения отбирается 1-(3-ацетилтио-2-D-метил-пропанон)-L-пролин, и далее аналогично вышеописанному его подвергают аммонолизу с получением каптоприла.
http://bibliofond.ru/view.aspx?id=703911
Дата добавления: 2015-08-17; просмотров: 777 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ДИПЛОМНАЯ РАБОТА | | | Медь как комплексообразователь |