
Читайте также:
|
Понятие поперечный размер имеет четко выраженный смысл для сферических частиц (а равно диаметру d этих частиц) и для частиц, имеющих форму куба (а равно длине ребра l куба). Для частиц другой формы (нитевидных, пластинчатых и т.д.) величина а зависит от направления, в котором производят измерения. В таких случаях очень часто иную форму частиц приравнивают к сферической с определенной величиной d, считая, что эти условные частицы ведут себя в системах точно также как и реальные.
Иногда применяется и другая характеристика степени дисперсности – так называемая удельная поверхность Sуд., которая соответствует общей поверхности (м2) всех частиц дисперсной фазы, имеющих суммарную массу 1 кг или суммарный объем 1 м3. В первом случае Sуд. имеет размерность м2/кг, во втором – 1/м или м –1.
Таким образом, удельную поверхность можно определить так:
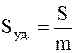 или
или 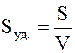
где S – суммарная площадь (м2) поверхности частиц дисперсной фазы;
m – общая масса (кг) этих частиц;
V – общий объем (м3) этих частиц.
Существует прямо пропорциональная зависимость между Sуд. и D:
Sуд. = k · D
где k – коэффициент пропорциональности.
В дисперсных системах частицы дисперсной фазы редко бывают одинакового размера. Их можно получить такими только искусственно, пользуясь специальными приемами. В этом случае образовавшиеся системы называются монодисперсными. Реальные системы чаще всего являются полидисперсными и размеры частиц дисперсной фазы в них лежат в определенном интервале.
Все дисперсные системы по величине частиц дисперсной фазы можно условно разделить на 3 группы (табл. 14).
Таблица 14. Классификация дисперсных систем по размерам частиц дисперсной фазы
| Поперечный размер частиц дисперсной фазы, а | Название системы |
| < 10–9 м | Молекулярно(ионно)-дисперсные системы (истинные растворы) |
| 10–9 м ÷ 10–7 м | Коллоидно-дисперсные системы (золи) |
| 10–7 м ÷ 10–5 м | Грубо-дисперсные системы |
Границы между этими типами систем нельзя установить точно. Для отдельных систем она может быть сдвинута в ту или иную сторону в зависимости от химической природы вещества дисперсной фазы и дисперсионной среды и физико-химических свойств самой системы.
Отличительной особенностью истинных растворов является то, что частицы дисперсной фазы в них представляют собой отдельные молекулы или ионы. Вследствие этого в данных системах отсутствует межфазная поверхность и поэтому в отличие от других дисперсных систем они являются гомогенными.
В коллоидно-дисперсных системах (или золях) частицы дисперсной фазы образованы несколькими десятками либо сотнями молекул, ионов или атомов, соединенных друг с другом различными связями.
Поперечные размеры таких частиц колеблются от 1 нм до 300-400 нм (1 · 10–9 ÷ 4 · 10–7 м). Из-за своих малых размеров они не могут быть визуально обнаружены с помощью светового микроскопа. Характерной особенностью коллоидных систем является их значительная удельная поверхность (табл. 15), вследствие чего их часто называют ультрамикрогетерогенными.
Таблица 15. Изменение площади поверхности при дроблении 1 см3 вещества
| Длина грани кубика l, м | Число кубиков | Общая площадь поверхности, м2 |
| 1 · 10–2 | 0,0006 | |
| 1 · 10–3 | 1 · 103 | 0,006 |
| 1 · 10–4 | 1 · 106 | 0,06 |
| 1 · 10–5 | 1 · 109 | 0,6 |
| 1 · 10–6 | 1 · 1012 | |
| 1 · 10–7 | 1 · 1015 | |
| 1 · 10–8 | 1 · 1018 | |
| 1 · 10–9 | 1 · 1021 |
Это приводит к тому, что большая часть всех молекул или атомов вещества дисперсной фазы находится на поверхности его частичек, т.е. на границе раздела фаз. Вследствие этого коллоидные системы приобретают особые свойства, которые резко отличают их от других типов дисперсных систем.
Физико-химические свойства коллоидных систем, процессы, протекающие на поверхности их частиц, изучаются в разделе физической химии, выделившимся в самостоятельную область науки – коллоидную химию .
Название «коллоидная химия» произошло от греческого слова kola – клей и eidos – вид. Его предложил английский ученый Томас Грэм, изучавший во второй половине XIX века диффузию из растворов различных веществ через растительные и животные мембраны.
Томас  Грэм (1805-1869), шотландский химик. Работы Грэма посвящены диффузии в газах и жидкостях, коллоидной химии, химии многоосновных кислот. Грэму принадлежит идея разделения всех веществ на кристаллоиды и коллоиды. Первые образуют стойкие растворы и кристаллизуются, вторые дают нестойкие растворы и легко коагулируют, образуя студенистый осадок. Эти работы заложили основы коллоидной химии. Продолжая исследования газов, Грэм в конце 1860-х годов открыл явление окклюзии – поглощения газов микроскопическими полостями в металлах.
Грэм (1805-1869), шотландский химик. Работы Грэма посвящены диффузии в газах и жидкостях, коллоидной химии, химии многоосновных кислот. Грэму принадлежит идея разделения всех веществ на кристаллоиды и коллоиды. Первые образуют стойкие растворы и кристаллизуются, вторые дают нестойкие растворы и легко коагулируют, образуя студенистый осадок. Эти работы заложили основы коллоидной химии. Продолжая исследования газов, Грэм в конце 1860-х годов открыл явление окклюзии – поглощения газов микроскопическими полостями в металлах.
При этом вещества, которые быстро диффундируют в растворе и хорошо проходят через мембрану, были названы им кристаллоидами, т.к. при высаждении они образуют плотные осадки, имеющие кристаллическую структуру.
Вещества, обладающие малой способностью к диффузии в растворе и непроходящие через диализационные мембраны получили название коллоиды, т.е. клееподобные. Возникновение данного названия связано с тем, что первыми объектами такого типа, исследованными ученым Т. Грэмом являлись растворы различных высокомолекулярных соединений: полисахаридов, белков, которые при высаждении, как правило, образуют клейкие осадки, имеющие аморфную структуру.
Дальнейшие работы в этой области других ученых: И.Г. Борщова, П.П. Веймарна, Д.И. Менделеева – показали, что одно и тоже вещество в зависимости от вида дисперсионной среды может проявлять в растворах как свойства коллоидов, так и свойства кристаллоидов. Так, например, мыло, растворенное в Н2О, обладает свойствами коллоида, а раствор мыла в спирте – кристаллоида; поваренная соль, растворенная в Н2О, образует истинный раствор, а в бензоле – коллоидный.
Дата добавления: 2015-08-02; просмотров: 72 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Определение дисперсных систем | | | Таким образом, нет оснований подразделять химические соединения на два обособленных класса, а можно говорить лишь о кристаллоидном и коллоидном состоянии вещества в растворе. |