
Читайте также:
|
комплексного оксалата марганца
Цель работы: рассчитать значение константы скорости реакции при разных температурах и энергию активации.
Распад комплексного соединения марганца протекает по реакции первого порядка согласно уравнению:
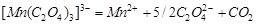 .
.
Поскольку комплексный ион окрашен, а продукты реакции бесцветны, то для изучения кинетики реакции используют колориметрический метод. В основе метода лежит объединенный закон Бугера-Ламберта-Бэра, выражающий зависимость поглощения света от концентрации окрашенного вещества и толщины поглощаемого слоя:
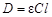 ,(93)
,(93)
где 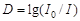 - оптическая плотность;
- оптическая плотность;
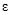 - коэффициент экстинкции, величина постоянная для растворов данного вещества при прохождении света с определенной длиной волны;
- коэффициент экстинкции, величина постоянная для растворов данного вещества при прохождении света с определенной длиной волны;
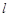 - толщина поглощающего слоя;
- толщина поглощающего слоя;
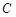 - концентрация вещества.
- концентрация вещества.
Следовательно, согласно закону Бугера-Ламберта-Бэра, концентрация исследуемого вещества будет прямопропорциональна оптической плотности:
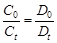 ,
,
где  и
и 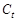 - концентрация исследуемого вещества в начальный момент времени и в момент времени
- концентрация исследуемого вещества в начальный момент времени и в момент времени  ;
;
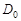 и
и 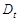 - оптическая плотность раствора в начальный момент времени и в момент времени
- оптическая плотность раствора в начальный момент времени и в момент времени  .
.
Для вычисления константы скорости реакции первого порядка по уравнению:
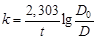 ,(94)
,(94)
достаточно измерить оптическую плотность исследуемого раствора во времени.
Работа на фотоэлектроколориметре ФЭК-М.
Фотоэлектроколориметр (рис. 13) включить в сеть за 15 мин до начала измерений. Во время прогрева крышку кюветного отделения открыть. Светофильтр установить на значение 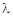 = 440 нм (светофильтр синий). Ручку чувствительности установить в положение “2”, ручку установки “100” (грубо) - в крайнее левое положение.
= 440 нм (светофильтр синий). Ручку чувствительности установить в положение “2”, ручку установки “100” (грубо) - в крайнее левое положение.
В световой пучок поместить кювету (1 см) с дистиллированной водой и кювету с исследуемым раствором. Закрыть крышку кюветного отделения. Ручкой «установка» 100 грубо и точно установить отсчет 100 по шкале колориметра. Затем поворотом ручки кювету с водой заменить кюветой с исследуемым раствором. Снять показания по шкале оптической плотности (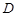 ).
).
Порядок выполнения работы:
Приборы и реактивы:
фотоэлектроколориметр ФЭК,
электроплитка,
водяная баня,
секундомер,
конические колбы 250 мл,
стаканчики,
бюретки 25 мл и градуированные пипетки,
растворы 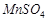 ,
, 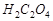 ,
, 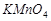 .
.
1. Приготовить исходные реактивы для получения комплексного оксалата марганца:
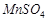 - 0,1 моль/л;
- 0,1 моль/л;
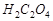 - 0,1 моль/л;
- 0,1 моль/л;
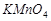 - 0,01 моль/л.
- 0,01 моль/л.
2. Подготовить для измерений фотоколориметр: включить его в электросеть, выдержать время, необходимое для стабилизации прибора и настроить его по дистиллированной воде.
3. Приготовить 10 мл раствора комплексного оксалата марганца последовательным приливанием в стакан 2 мл сульфата марганца (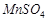 ), 7 мл щавелевой кислоты (
), 7 мл щавелевой кислоты (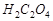 ) и в последнюю очередь добавить 1 мл перманганата калия (
) и в последнюю очередь добавить 1 мл перманганата калия (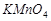 ). Все растворы брать соответствующими пипетками. При этом образуется комплексная соль, которую быстро наливают в кювету и измеряют оптическую плотность.
). Все растворы брать соответствующими пипетками. При этом образуется комплексная соль, которую быстро наливают в кювету и измеряют оптическую плотность.
4. Периодически измерять оптическую плотность реакционной смеси. Отсчет производится по секундомеру сначала через 1 минуту, а затем через 3 минуты. Опыт прекращают, когда оптическая плотность достигнет значений близких к 0,1. Полученные результаты заносят в таблицу 13.
5. Рассчитать величину константы скорости по уравнению (94). Значение 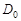 найти экстраполяцией по графику
найти экстраполяцией по графику 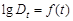 . Среднюю скорость реакции сравнить со средней, найденной по тангенсу угла наклона прямой к оси времени
. Среднюю скорость реакции сравнить со средней, найденной по тангенсу угла наклона прямой к оси времени 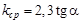 .
.
Таблица 13.
Температура опыта,°С
| № п/п | Время от начала опыта, мин | 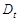
| 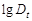
| 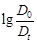
|  , мин-1 , мин-1
|
6. Аналогичный опыт и расчеты повторить при более низкой температуре. При этом исходные реактивы в отдельных стаканчиках помещают в термостат до установления заданной температуры (+12  + 15 °С).
+ 15 °С).
7. По полученным значениям константы скорости реакции рассчитывают энергию активации по формуле (43).
Контрольные вопросы.
1. Какому порядку подчиняется реакция разложения комплексного оксалата марганца?
2. Дайте определение скорости и константы скорости химической реакции.
3. Почему для изучения кинетики данной реакции удобно использовать колориметрический метод?
4. Что называется энергией активации?
Литература.
1. Практикум по физической химии / Под ред. И.В. Кудряшова - М.: Высшая школа, 1986. – 495 с.
2. Панченков Г.М., Лебедев В.П. Химическая кинетика и катализ. - М.: Химия, 1985. – 592 с.
3. Еремин Е.Н. Основы химической кинетики. – М.: Высшая школа, 1976. – 374 с.
4. Стромберг А.Г., Семченко Д.П. Физическая химия. – М.: Высшая школа, 2001. – 527 с.
5. Липатников В.Е., Казаков К.М. Физическая и коллоидная химия. - М.: Высшая школа, 1981. – 158 с.
6. Барковский В.Ф. Гордепцева Т.Б. Основы физико-химических методов анализа. - М.: Высшая школа, 1983. – 294 с.
7. Краткий справочник физико-химических величин / Под ред. А.А. Равделя, А.М. Пономаревой. - Л.: Химия, 1983. – 231 с.
Содержание:
1.ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ...................................................... 3
Лабораторная работа №1........................…..................................... 37
Изучение кинетики разложения серноватистокислого натрия колориметрическим методом.............…................................................ 37
Лабораторная работа №2...........................….................................. 43
Изучение кинетики гомогенного каталитического разложения
пероксида водорода газометрическим методом............................….... 43
Лабораторная работа №3.......................................…...................... 51
Определение константы скорости и энергии активации реакции
кислотного гидролиза этилацетата титриметрическим методом….... 51
Лабораторная работа №4...................................................….......... 55
Изучение скорости омыления этилацетата в присутствии ионов
гидроксида кондуктометрическим методом..................................….... 55
Лабораторная работа №5.......................................................…...... 62
Изучение кинетики гетерогенного процесса цементации меди
титриметрическим методом........................................................…….... 62
Лабораторная работа №6................…........................................…. 66
Изучение кинетики термического разложения перманганата калия
газометрическим методом..............................................................……. 66
Лабораторная работа №7.............................................................… 68
Спектрометрическое измерение скорости разложения комплексного оксалата марганца……………………………………….68
Литература...................................................................................…… 72
Дата добавления: 2015-08-10; просмотров: 165 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Изучение кинетики термического разложения | | | Химическая классификация минералов |