
Читайте также:
|
Наважку об’єкту аналізу взяти з таким розрахунком, щоб одержати 200мл приблизно 0,05н. розчину.
Розрахунок наважки проводиться за такою формулою:
m=N*E*V
де m - наважка в г
N – нормальна концентрація розчину об’єкту аналізу, г-екв/л;
Е-еквівалентна маса об’єкту аналізу;
V – об’єм мірної колби для приготування розчину, л.
Е(СuO) = 79,54
m = 0,05*79,54*0,2 = 0,7954
В колбу для титрування дозатором перенести 20мл 10% КІ,потім піпеткою додати 20мл. розчину сполуки міді, перемішати. Колбу накрити скельцем і поставити у темне місце на 7-10хв. до завершення реакції. В колбі може утворитися осад бурого кольору або розчин набуде жовто-коричневого кольору. Від титрувати вміст колби розчином тіосульфату натрію до світло-жовтого кольору. Потім додати 2-3мл крохмалю (вміст колби набуває сіро-синього кольору) і продовжити обережно титрувати до утворення молочно-білого кольору.
Титрування повторити 2-3 рази.
| № титрування | Нормальність Na2S2O3 | Об’єм піпетки | Об’єм Na2S2O3 | Маса наважки | |
| 0,05 | 16,5 | 0,645 | |||
| 0,05 | 16,4 | 0,645 | |||
| 0,05 | 16,4 | 0,645 |
Відсотковий вміст міді в розрахунку СuO обчислюється за формулою:
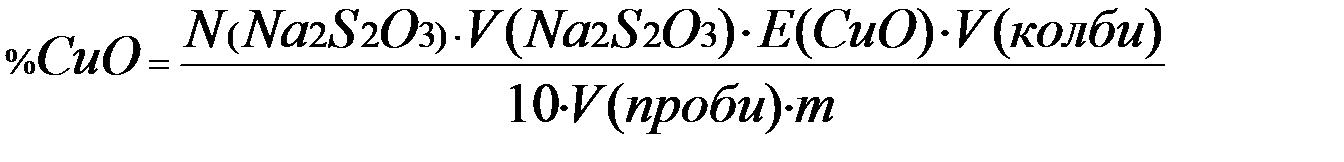
де N (Na2S2O3) - нормальність тіосульфату натрію, г-екв/л;
Vколби – об’єм мірної колби, мл;
Vпроби – об’єм піпетки, мл;
m – маса наважки
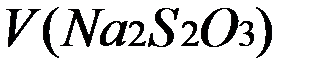 - Об’єм тіосульфату натрію, що пішло на титрування.
- Об’єм тіосульфату натрію, що пішло на титрування.
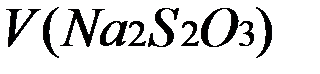 =49.3/3=16.433
=49.3/3=16.433
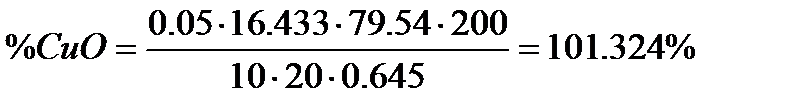
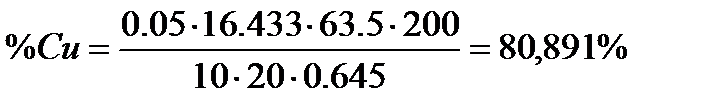
Дата добавления: 2015-08-10; просмотров: 57 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Умови проведення йодометричних визначень | | | Хід роботи |