
|
Читайте также: |
У плазмі і формених елементах містяться гістамін, гормони і наступні ферменти: амілаза, сахараза, мальтаза, протеаза, ліпаза, пероксидаза, каталаза, редуктаза. Останні три мають істотне значення в процесах імунної відповіді комах і входять до антиоксидантної системи. Вони нейтралізують і елімінують як вторинні продукти метаболізму патогенних мікроорганізмів, так і безпосередньо продукти життєдіяльності власних клітин, які можуть утворюватися при виникненні та перебігу ряду захворювань
АФК в якості побічних продуктів аеробного метаболізму безперервно формуються в клітинах бджіл у нормальних фізіологічних умовах, і вони вимагають постійного моніторингу антиоксидантної системи [21].
У результаті окисно-відновних реакцій в організмі бджоли, як і в інших живих організмах постійно проходить генерація активних форм кисню: супероксид (О• 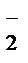 ), перекис водню (H2O2), гідроксильний радикал (HO•-), перекис ліпідів (LOOH), гіпохлоритна кислота (HOCl) та інші, які відіграють важливу роль у багатьох фізіологічних і біохімічних процесах: регуляції тонусу судин, клітинній проліферації, синтезі простагландинів, передачі сигналів від міжклітинних сигнальних молекул на регуляторні системи.
), перекис водню (H2O2), гідроксильний радикал (HO•-), перекис ліпідів (LOOH), гіпохлоритна кислота (HOCl) та інші, які відіграють важливу роль у багатьох фізіологічних і біохімічних процесах: регуляції тонусу судин, клітинній проліферації, синтезі простагландинів, передачі сигналів від міжклітинних сигнальних молекул на регуляторні системи.
Будь-яка стресова реакція організму в нормі супроводжується короткочасним збільшенням кількості АФК. Це зумовлено адаптацією організму до екстремальних умов, за яких АФК відіграють роль вторинних мессенджерів, беручи участь у сигнальній трансдукції та активації факторів транскрипції відповідних генів, зокрема тих, що кодують ферменти антиоксидантої системи [6].
В випадках коли швидкість утворення АФК переважає над швидкістю їх детоксикації відбувається пошкодження клітин. При вираженому або тривалому стресі концентрація АФК у клітині може підвищуватися і починаючи з певного порогового рівня цих сполук, мобілізація захисних систем клітини слабшає і активуються процеси, які спричиняють апоптоз або некроз.
Захист організму бджоли від деструктивної дії АФК забезпечує антиоксидантна система (АОС).У процесі еволюції аеробного організму, комплексні антиоксидантні системи, в тому числі ферментативних і неферментний компонентів, були створені, щоб запобігти окислювальному пошкодженню [17]. До ферментативних відносяться первинні і вторинні антиоксидантні ферменти, які впливають на молекули АФК прямо або побічно.
Захист від руйнівної дії АФК спочатку забезпечується трьома групами первинних антиоксидантних ферментів шляхом прямої дії.
Супероксиддисмутаза (SOD) перетворює радикал (О• 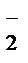 ) супероксид аніону – на пероксид водню (Н2О2), який потім нейтралізує каталаза.
) супероксид аніону – на пероксид водню (Н2О2), який потім нейтралізує каталаза.
О• 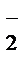 + О•
+ О• 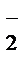 + 2Н+ ® 1 О2 + Н2О2
+ 2Н+ ® 1 О2 + Н2О2
У результаті цієї реакції утворюється пероксид водню, здатний інактивувати SOD [13]. Тому SOD локалізована і функціонує звичайно разом з каталазою, яка розкладає Н2О2. Супероксиддисмутаза є першою лінією захисту організму проти вільних радикалів кисню. SOD разом з каталазою мають сильні антиоксидантні властивості. Але каталаза не така ефективна при знешкоджені H2O2 в порівняні з аскорбатпероксидазою (APOX), яка служить краще в детоксикації H2O2 [11].
Пероксидази каталізують подібні реакції, в яких Н2О2 перетворюється на Н2О з використанням тіоредоксина (TRX), глутатіону (GSH) або аскорбату в якості донора електронів. Вважалось, що аскорбатпероксидаза була відсутня в організмі Apis Mellifera, але нещодавні дослідження підтвердили наявність цього фермента в організмі комахи.
Вперше APOX у комах була знайдена у личинок Helicoverpa Zea. Так як комахи мабуть не мають GPX і каталаза не така ефективна при знешкоджені H2O2, тому цей фермент мабуть може відігравати важливу роль у детоксикацыъ H2O2 в комах і відповідно убджіл. Так як APOX була знайдена в жирових тканинах тіла комах, вважаться, що вона може бути важливим ферментом у детоксикації ліпідних пероксидів у комах [18].
APOX комах має ширшу специфічність до донорів електронів, ніж APOX рослин і також вона стійкіша до дії багатьох відомих інгібіторів APOX рослин, припускаючи, що фермент комах має інший активний центр.
Відомо, що APOX бджолиного організму була виявленна у гібридів утворених схрещуванням єгипетської породи Egyptian із західноєвропейською породою Carniolan. Зразки були взяті з факультету сільськогосподарської пасіки, Асьютського університету (Асьют, Єгипет) [10].
Вже відомо, що CAT не ефективна при розщеплені H2O2, тому комахи можуть використовувати іншу стратегію для підтримання безпесного рівня перекису, як раз APOX краще виконую цю роль. Вона хоч знаходиться в організмі в не великих концентраціяї, порівняно з СAT і конкурує з нею за розщеплення H2O2, але все ж APOX може компенсувати каталазу у випадках пов’язаних із зниженням її концентрації.
APOX також може мати інший ефект на пероксиди і гідропероксиди. Ферментативна активність APOX залежить не тільки від спорідненості до Н2О2, але також залежить від двох ліпофільних пероксидів – кумілгідропероксид і третбутилгідропероксид. На противагу цьому, коли оксидативний стрес зменшується, тобто коли зменшувались концентрації Н2О2, то і активність APOX теж знижується, паралельно збільшується активність SOD і не існує більше необхідності у ферментативній дії APOX.
Ключові компоненти системи антиоксидантного захисту зберігаються в організмах всіх еволюційних гілок, але є унікальні для адаптації окремих груп. У комах в порівнянні з хребетними та інших філогенетичними групами, гени, що кодують глутатіонредуктазу (GR) і глутатіонпероксидазу (GPX) відсутні. Їх функції виконують гомологічні гени, що кодують тіоредоксинредуктазу (TrxR) і тіоредоксинпероксидазну (ТРХ). Крім того, комахи мають гени, які кодують ферменти подібні пероксидазам – фосфоліпідгідропероксиди: глутатіон S-трансферази (GST) і гомолог ТРХ з GSH (GTPX).
Таким чином, група вторинних антиоксидантних ферментів в комах, діючих на АФК побічно включають TrxR, який працює з TRX і GSH, а також метіонінсульфоксидредуктази (MsrA і MsrB), які беруть участь у репарації білка для каталізування TRX-залежного перетворення метіонінсульфоксида до метіоніна [17]. Антиоксидантні ферменти бджоли представляють особливий інтерес через їх потенційну участь в деяких біологічних характеристик королеви, особливо цікавить її довговічність у порівнянні з робочими бджолами [14]. Тривалість життя бджіл тісно пов'язана з функціонуванням вітеллогеніна. Особливістю довгоживучих бджіл є висока концентрація вітеллогеніна в гемолімфі, що позитивно впливає на клітинний імунітет, збереження цілісності білків і підвищення стійкості до оксидативного стресу [24, 25].
Вітеллогенін є попередник глікопротеїну яєчного жовтка, що бере участь у розвитку репродуктивних функцій самки комах і є поживною речовиною для бджолиного розплоду, який виконує антиоксидантну функцію в бджолиному організмі [25].
Антиоксидантні властивості вітеллогеніну обумовлені його здатністю зв’язувати Zn та приймати участь у окисному карбонілюванні при окисному стресі у бджіл. Відносно цих властивостей, вітеллогенін порівнюється з Cu/Zn-SOD і білком альбуміном.
Кодування повних геномів кількох видів комах дозволяє зробити попереднє порівняння. Було виявлено що, геном бджоли розвивався повільніше, ніж геноми дрозофіли і комара. У цьому випадку геном бджоли відносно генів, що беруть участь в циркадному ритмі, РНК-інтерференції і метилюванні ДНК дає більше схожості з геномами хребетних, ніж плодової мушки і комара. Також порівняно з Drosophila melanogaster і Anopheles gambiae, є менше генів представлених в геномі Apis Mellifer, пов'язаних з вродженим імунітетом, детоксикацією білків, і смаковими рецепторами але є багато генів пов'язаних з рецепторами пахучих речовин [15]. Таке велике розходження пояснюються відмінністю в історії життя та екологічною нішою між соціальними і відокремленими видів [13]. На сьогоднішній день відомо 39 генів, що кодують 10 груп антиоксидантних білків (Табл. 1) [17].
Таблиця 1.2.2.1.
Дата добавления: 2015-07-12; просмотров: 167 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Характеристика імунної системи медоносної бджоли | | | Антиоксидантні білки бджоли медоносної |