
Читайте также:
|
| Ксапр, % | Категория воды |
| < 0,03 | Особо чистая |
| 0,03 | Чистая |
| 0,30 | Грязная |
| 3,00 | Особо грязая |
Помимо определения численности олиготрофов и копиотрофов производится качественный анализ бактериопланктона по следующей схеме. На основании внешних различий выделяются основные морфофизиологические типы строго аэробных колоний, и подсчитывается количество колоний каждого типа. Колонии описываются по следующим критериям: форма, характер поверхности, краев, профиля, цвет, средний диаметр. Затем, из колонии каждого морфологического типа приготавливают препараты для микрокопирования (окрашивание фуксином) и определяют основные признаки бактерий: морфологию клеток, наличие спор. Дифференцирование по Грамму проводят без окрашивания (с использованием 3%-ого раствора КОН).
Установлено, что в большинстве природных вод доминируют подвижные грамотрицательные палочки. Наличие спорообразующих бактерий коррелирует со степенью трофности водоема: в олиготофных водоемах они составляют не более 10%, в мезотрофных – 20-25%, в дистрофных – более 85%. В относительно чистых водах среди копиотрофов преобладают кокки (до 80%). При загрязнении возрастает доля спороносных и других палочковидных форм (до 80%), появляются вибрионы (более 10%), количество кокков падает (ниже 10%).
О наличии загрязнения водоема можно судить по изменению численности микроорганизмов, осуществляющих специфические геохимические процессы. Одним из таких процессов является сульфатредукция. Сульфатвосстанавливающие бактерии участвуют в анаэробной минерализации органического вещества и поддержании окислительно-восстановительного баланса водоема. Повышенная численность сульфатредуцирующих бактерий является показателем загрязнения водоема избытком органического вещества, с которым не способна справиться аэробная микробиота, поэтому деструкция переходит в анаэробную зону. Реже повышенная численность сульфатредукторов свидетельствует о загрязнении водоема сульфатами.
Определение численности этой группы бактерий производят методом наиболее вероятного числа при посеве на селективную питательную среду ван Дельдена (аспарагин, MgSO4*7H2O, K2HPO4, лактат, FeSO4*7H2O, водопроводная вода, рН = 7-7,5) в анаэробных условиях. Посевы производят в серии разведений: 100, 101, 102, 103, 104. Каждый вариант разведения делается в трех повторностях. Посевы содержаться в термостате 3-4 недели при температуре 28оС. После этого производят учет пробирок/флаконов, в которых наблюдается положительная реакция на присутствие сульфатредукторов (запах сероводорода или выпадение черного осадка сульфидов). На основе этих данных составляется числовая характеристика, по которой с использованием таблиц Мак-Креди определяют наиболее вероятное число (НВЧ). Численность микроорганизмов определяют путем перемножения НВЧ на коэффициент разведения.
Одним из интегральных показателей состояния водоема является биомасса микроорганизмов. Сырая биомасса (В) определяется на основе общей численности по формуле:
В = Nобщ.  v
v  ρ
ρ  f [мг/мл], (5)
f [мг/мл], (5)
где Nобщ – численность бактериопланктона (кл/мл), v - вычисленный из измерений объем одной клетки (в среднем для водных бактерий равный 0,5 мкм3), ρ - плотность сырой бактериальной массы (≈1 г/см2), f - фактор усыхания клеток (≈1,6).
Для определения сухой биомассы (Вс) в весовых единицах сухой массы углерода исходят из предположения, что сухое вещество составляет 15% от общей массы, а доля углерода в сухом веществе равна 50%. Тогда расчет принимае вид:
Вс = В  0,15
0,15  0,5 [мг/мл], (6)
0,5 [мг/мл], (6)
Для оценки интенсивности микробиологических процессов определяют значения удельной скорости роста (μ), времени генерации (g), продукции (Р), скорости выедания (G) и потенциальных скорости роста (μ ’) и времени генерации (g’).
Для определения показателей удельной скорости роста и времени генерации пробу воды фильтруют для удаления зоопланктона (элиминирующего фактора). Таким образом получают величины, характеризующие истинную скорость роста бактерий. Определяют общую численность бактерий в пробе методом прямого счета до экспозиции (N0). Затем, инкубируют пробу в течение времени, соответствующего времени генерации. Эмпирически установленная величина, соответствующая времени генерации бактерий в мезофильных озерах равна 1-6 часам. После экспозиции так же определяют общую численность (Nt). Исходя из полученных значений численностей находят значения биомассы микроорганизмов до (В0) и после (Вt) экспозиции. Исходя из полученных данных можно вычислить удельную скорость роста (μ) бактерий:


 (7)
(7)
где В – биомасса микроорганизмов, t – время экспозиции и часах., значения биомассы определяют по формуле 5.
Вторая характеристика, необходимая для оценки продукции, - это время генерации – период времени, за которое произойдет удвоение числа бактериальных клеток. Рассчитывается на основании удельной скорости роста по формуле:
g = ln2/ μ (8)
Для определения продукции (Р) и скорости выедания бактерий определяют показатели численности в нефильтрованной пробе с зоопланктоном до (n0) и после (nt) инкубации. На основе полученных данных рассчитывают биомассы в начале и в конце инкубации - b0 и bt соответственно. Реальное изменение биомассы бактерий в нефильтрованной пробе определяется уравнением:
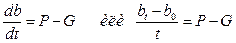 (9)
(9)
Продукция (Р) – это скорость образования бактериальной биомассы, равная приросту биомассы за единицу времени (мг/л/ч).
Р = dB/dt = μ ∙ b0(10)
Подставив выражение (9) в уравнение (10), получим выражение для нахождения скорости выедания (G).

(11)
В ряде случаев (в эвтрофных водоемах) удаление зоопланктона может приводить к снижению притока РОВ, являющихся продуктами метаболизма зооплактона, которые усваиваются гетеротрофными бактериями. Следовательно, чтобы определить наличие или отсутствие данного явления, необходимо поставить третий вариант опыта: фильтрованную пробу с добавлением легко усваиваемого субстрата – глюкозы. Производят определение численности микроорганизмов до (N0) и после (Nt) экспозиции. На основании данных о численности определяют значения биомассы до и после экспозиции, рассчитывают потенциальную скорость роста бактерий (μ ’) и время генерации (g’) Если μ ’ меньше, чем μ, то можно предполагать наличие субстратного ингибирования. Следовательно, для развития микроорганизмов данного водоема необходимо наличие зоопланктона, прижизненные выделения которого являются субстратом для данных бактерий.
2. Экспериментальная часть
2.1. Объект исследования
Объектом исследования являлся модельный водоем, имеющий следующие характеристики:
2.2. Материалы и методы исследования
Дата добавления: 2015-10-21; просмотров: 93 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Общая численность бактерий в различных природных озерах и водохранилищах | | | Результаты и их обсуждения |