
Читайте также:
|
Тема 2. Белки
Лекция 2. Аминокислоты и белки
Аминокислоты, их физико-химические свойства и классификация. Заменимые и незаменимые аминокислоты. Структура пептидной связи.
Первичная, вторичная, третичная и четвертичная структуры белков. Пептидные, дисульфидные, ионные, водородные связи и гидрофобные взаимодействия. Домены в структуре белка.
3. Принципы классификации белков: глобулярные и фибриллярные белки; простые и сложные белки; глобулярные и фибриллярные белки. Функциональная классификация белков.
Физико-химические свойства белков. Денанурация белков. Методы исследования пептидов и белков.
| Краткое содержание | Конспект |
| 1. Аминокислоты, их физико-химические свойства и классификация. Заменимые и незаменимые аминокислоты. Структура пептидной связи | |
Структурная формула аминокислоты:
H
│
H2N — Cα — COOH
│
R
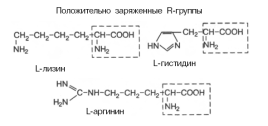
Классификации аминокислот: 1. Структурная(по строению бокового радикала) – ациклические(алифатические), циклические(ароматические, гетероциклические), иминокислота– пролин (относится к циклическим аминокислотам). 2. Электрохимическая (кислотно-основные свойства): кислые аминокислоты (с дополнительными карбоксильными группами в боковом радикале – аспарагиновая, глутаминовая); основные аминокислоты (с дополнительными аминогруппами в боковом радикале – лизин, аргинин, гистидин); нейтральныеаминокислоты (в боковом радикале нет группировок, проявляющих кислые или основные свойства – все остальные аминокислоты). 3. Биологическая, или физиологическая(по степени незаменимости аминокислот для организма): незаменимые(не могут синтезироваться в организме человека из других соединений, поэтому обязательно должны поступать с пищей) – валин, лейцин, изолейцин, треонин, лизин, метионин, фенилаланин, триптофан; полузаменимые(образуются в организме человека, но в недостаточном количестве и тоже должны поступать с пищей) – аргинин, тирозин, гистидин; заменимые(синтезируются в организме человека в достаточном количестве из незаменимых аминокислот или других соединений). 4. Классификация аминокислот по растворимости их радикалов в воде: аминокислоты с неполярными радикалами (гидрофобные) – аланин, валин, лейцин, изолейцин, пролин, метионин, фенилаланин, триптофан; аминокислоты с полярными незаряженными радикалами (радикалы этих аминокислот лучше, чем гидрофобные радикалы растворяются в воде) – серин, треонин, тирозин, аспарагин, глутамин, цистеин; аминокислоты с полярными отрицательно заряженными радикалами (аминокислоты имеют в радикале дополнительную карбоксильную группу) – глутаминовая и аспарагиновая кислоты; аминокислоты с полярными положительно заряженными радикалами - лизин, аргинин, гистидин
Свойства аминокислот
Изменение суммарного заряда аминокислот в зависимости от рН среды
 Состояние, в котором заряд аминокислоты равен нулю, называется изоэлектрическим. Значение рН, при котором наступает такое состояние, называется изоэлектрической точкой.
Все протеиногенные аминокислоты, за исключением глицина, имеют как минимум один асимметрический атом углерода и обладают оптической активностью. По расположению заместителей вокруг асимметрического атома углерода стереоизомеры относят к L - или D- ряду. Все аминокислоты, из которых синтезируется белок, относятся к L -ряду.
Образование пептидов в результате реакций конденсации:
Состояние, в котором заряд аминокислоты равен нулю, называется изоэлектрическим. Значение рН, при котором наступает такое состояние, называется изоэлектрической точкой.
Все протеиногенные аминокислоты, за исключением глицина, имеют как минимум один асимметрический атом углерода и обладают оптической активностью. По расположению заместителей вокруг асимметрического атома углерода стереоизомеры относят к L - или D- ряду. Все аминокислоты, из которых синтезируется белок, относятся к L -ряду.
Образование пептидов в результате реакций конденсации:
 Дипептид
Дипептид
| Структурные формулы аминокислот
 
 Обозначить пептидную связь и пептидную группу.
Обозначить пептидную связь и пептидную группу.
|
| 2. Первичная, вторичная, третичная и четвертичная структуры белков. Пептидные, дисульфидные, ионные, водородные связи и гидрофобные взаимодействия. Домены в структуре белка | |
Классификация пептидов и белков по количеству аминокислотных остатков: 1. Олигопептиды– пептиды, содержащие до 10 аминокислот (трипептид, пентапептид, октапептид и т.д.). 2. Полипептиды– пептиды, содержащие более 10 аминокислот (окситоцин, вазопрессин и пр.). 3. Белки– полипептиды, состоящие из более чем 50 аминокислотных остатков (инсулин – 51 аминокислотных остатков и др.).
Классификация пептидов по физиологическому действию:Пептиды, обладающие гормональной активностью Пептиды, регулирующие процессы пищеварения). 2. Пептиды, регулирующий тонус сосудов и артериальное давление. 3. Пептиды, регулирующие аппетит. 4. Пептиды, обладающие обезболивающим действием. 5. Пептиды, участвующие в регуляции высшей нервной деятельности.
Классификации белков: 1) по пространственной структуре; 2) по форме; 3) по химическому строению; 4) по функциям.
1. Классификация белков по пространственной структуре: первичная, вторичная, третичная и четвертичная структуры.
Первичная структура белков – последовательность аминокислот в полипептидной цепи, качественный и количественный состав аминокислот в белке.
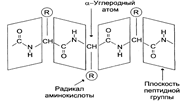 Вторичная структура белков –способ укладки полипептидной цепи в упорядоченную структуру благодаря образованию водородных связей между пептидными группами одной цепи или смежными полипептидными цепями По конфигурации вторичные структуры делятся на спиральные (α-спираль) и слоисто-складчатые (β-структура).
Вторичная структура белка в виде α-спирали
Вторичная структура белков –способ укладки полипептидной цепи в упорядоченную структуру благодаря образованию водородных связей между пептидными группами одной цепи или смежными полипептидными цепями По конфигурации вторичные структуры делятся на спиральные (α-спираль) и слоисто-складчатые (β-структура).
Вторичная структура белка в виде α-спирали
 Вторичная структура белка в виде β-складчатого слоя
Вторичная структура белка в виде β-складчатого слоя
 Доменная структура белков
Домен –это участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи конформацию глобулярного белка.
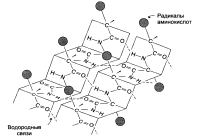
Третичная структура белков – трехмерная пространственная структура, образующаяся за счет взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Связи и взаимодействия, формирующие и поддерживающие третичную структуру:
Доменная структура белков
Домен –это участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи конформацию глобулярного белка.
Третичная структура белков – трехмерная пространственная структура, образующаяся за счет взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Связи и взаимодействия, формирующие и поддерживающие третичную структуру:
 1. Ионные связи. 2.Водородные связи. 3. Гидрофобные взаимодействия. 4. Дисульфидные связи.
Четвертичная структура белков –этоорганизация нескольких полипептидных цепей с третичной структурой в единую функциональную молекулу белка. Такой белок называется олигомерным, а полипептидные цепи, входящие в его состав – протомерами или субъединицами.
1. Ионные связи. 2.Водородные связи. 3. Гидрофобные взаимодействия. 4. Дисульфидные связи.
Четвертичная структура белков –этоорганизация нескольких полипептидных цепей с третичной структурой в единую функциональную молекулу белка. Такой белок называется олигомерным, а полипептидные цепи, входящие в его состав – протомерами или субъединицами.
| Влияние различных аминокислот на формирование α-спирали: 1. Способствуют: Ала, Асн, Цис, Глн, Гис, Лей, Мет, Фен, Тир, Вал. 2. Дестабилизируют: Арг, Асп, Глу, Гли, Лиз, Иле, Сер, Тре. 3. Препятствует: Про, Гидроксипролин. Какие аминокислоты обеспечивают образование связей и взаимодействий в белках, имеющих третичную структуру? Привести примеры белков, имеющих олигомерную конформацию. |
| 3. Принципы классификации белков: глобулярные и фибриллярные белки; простые и сложные белки; глобулярные и фибриллярные белки. Функциональная классификация белков | |
| Классификации белков: 1) по пространственной структуре (рассмотрено ранее); 2) по форме; 3) по химическому строению; 4) по функциям; 5) по растворимости. 2. Классификация белков по форме: глобулярные (соотношение продольной и поперечной осей не превышает 1:10, чаще – 1:3, 1:4). фибриллярные (соотношение продольной и поперечной осей более 1:10). 3. Классификация белков по химическому строению: простые (при гидролизе дают только аминокислоты); сложные (кроме аминокислот содержат небелковые – простетические – группы) белки. 4. Классификация белков по функциям: ферменты(катализаторы – каталаза, амилаза и др.),регуляторные(гормоны и др.),рецепторные (белки плазматических мембран),транспортные(альбумин крови, транспортные молекулы мембран, гемоглобин и др.),структурные (коллаген, эластин),защитные (иммуноглобулины, белки свёртывания крови),сократительные (актин, миозин, тубулин и пр.),резервные(овальбумин, глютелины и др.),токсигенные(ботулинический токсин, токсины змей и пр.),источник энергии. 5. Классификация белков по растворимости:строго установленных границ между классами белков не существует. Такая классификация используется особенно в клинической биохимии: альбумины(растворимы в воде и солевых растворах. Не имеют особенностей в смысле содержания отдельных аминокислот), глобулины(слаборастворимы в воде, но хорошо растворимы в солевых растворах. Не имеют особенностей в смысле содержания отдельных аминокислот), проламины(растворимы в 70-80%-ном этаноле, но нерастворимы в воде и в абсолютном этаноле. Богаты аргинином), гистоны(растворимы в солевых растворах), склеропротеины (нерастворимы в воде и солевых растворах. Повышено содержание Гли, Ала, Про) и др. | Привести примеры конкретных белков: - глобулярные: - фибриллярные: Привести примеры конкретных белков: - простые: - сложные: |
| 4. Физико-химические свойства белков. Денанурация белков. Методы исследования пептидов и белков | |
| Физико-химические свойства белков: амфотерность; буферные свойства; коллоидные и осмотические свойства; оптические свойства; малая скорость диффузии; высокая вязкость растворов белков; способность белков к образованию гелей; гидратация белков; высаливание; денатурация и ренатурация. Белки в их естественном биологически активном состоянии называетсянативными. Денатурация белков –это изменение нативной конформации белков под действием различных факторов, что приводит к потере их биологической функции. Денатурацию можно рассматривать как разупорядочение конформации полипептидной цепи без изменения первичной структуры. Денатурация может быть обратимой и необратимой. Ренатурация – возвращение белка в нативную конформация после снятия воздействия фактора. Методы исследования пептидов и белков: Гель-фильтрация. Жидкостная хроматография на колонках с обращенной фазой при высоком давлении. Высоковольтный электрофорез на молекулярных ситах. Автоматическая ионообменная хроматография. Расщепление полипептида на фрагменты, пригодные для автоматического секвенирования. Определение вторичной и третичной структур методом рунтгеновской кристаллографии. Ультрацентрифугирование. Центрифугирование в градиенте плотности сахарозы. Электронная микроскопия. |
Дата добавления: 2015-10-16; просмотров: 489 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Ас қорыту жүйесі» модулі | | | Глава 1 |