
Для каждого критического объекта инфраструктуры должна быть проведена квалификация, которая, как правило, осуществляется в четыре последовательных этапа:
- Квалификация проекта (DQ, D esign Q ualification)
- Квалификация монтажа (IQ, I nstallation Q ualification)
- Квалификация функционирования1 (OQ, O perational Q ualification)
- Квалификация в эксплуатации (PQ, P erformance Qualification)
Квалификация проекта (DQ) направлена на документированное подтверждение пригодности проекта (конструкции, проектного решения) технических средств, инженерных систем и оборудования для их предполагаемого использования. Объем работ на этом этапе:
- Описание системы (функция, параметры оборудования, особые характеристики)
- Техническая документация (нормативные требования, документация по оборудованию)
- Оценка конструкции (конструкционные материалы, оценка риска загрязнений)
- Компоненты/элементы оборудования/системы
- Анализ возможных отказов/дефектов
- Анализ способа изготовления (критические параметры работ при изготовлении оборудования, требования по калибровке)
Квалификация монтажа (IQ) направлена на документированное подтверждение того,
что технические средства, инженерные системы и оборудование сконструированы, оснащены и смонтированы в соответствии с рабочей документацией проекта и рекомендациями производителя. Объем работ на этом этапе:
- Наличие достаточной документации
- Наличие всех элементов в поставке
- Правильность монтажа и подключений
- Соответствие контактирующих материалов
- Соответствие средств измерений
Квалификация функционирования (OQ) направлена на документированное подтверждение того, что технические средства, инженерные системы и оборудование функционируют должным образом по всему заявленному диапазону рабочих характеристик. Объем работ на этом этапе:
- Приемлемость документации (инструкции по эксплуатации, обслуживанию);
- Испытания, включающие условие или ряд условий, охватывающих верхний и нижний пределы рабочих параметров:
- Срабатывание блокировок/сигнализаций.
Как правило, после этого этапа квалификации объект вводится в эксплуатацию.
Квалификация функционирования (PQ) проводится для инженерных систем, которые работают непрерывно, а также для оборудования со сложным управлением.
Квалификация в эксплуатации – это документированное подтверждение того, что технические средства, инженерные системы и оборудование при совместном (или длительном) использовании могут надежно функционировать с получением воспроизводимых свойств продукта.
При этом, если производственная система оснащена автоматизированной системой мониторинга параметров, или обработки данных, дополнительно должна проводиться валидация компьютеризированной системы.
Валидация аналитических методик
Каждая аналитическая и микробиологическая методика, которая используется для контроля качества сырья, полупродукта или готового продукта должна пройти валидацию. Это означает, что мы обязаны получить доказательства пригодности такой методики для контроля конкретного продукта и соответственно, гарантии получения достоверных результатов. В этом плане, требования GMP полностью совпадают с требованиями ИСО 17025.
Валидация очистки
Процедуры очистки оборудования должны также пройти валидацию до того, как мы приступим к производству препарата на этом оборудовании. Прежде всего, эта валидация направлена на получение гарантий возможности проведения качественной очистки после изготовления такого продукта. По сути, это минимизация риска перекрестного загрязнения при переходе на производство другого продукта на этом же оборудовании. Если на оборудовании останутся остатки предыдущего продукта, это не будет обнаружено – так как отсутствует аналитический контроль именно на наличие таких примесей.
Валидация асептических условий
При производстве стерильных лекарственных средств с использованием асептических технологий до начала самого технологического процесса необходимо подтвердить, что на всем протяжении процесса изготовления препарата (т.е. длительность процесса), в продукт не попадает ни один микроорганизм. Валидация асептических условий проводится по сценарию имитации с помощью питательных сред.
Валидация технологического процесса
И непосредственно, валидация каждого из этапов технологического процесса проводится на 3-х последовательных сериях с учетом «наихудшего случая». И, что очень важно, валидация технологического процесса проводится отдельно для каждого продукта и его заявляемого размера серии. Наихудший случай – это проведение процесса при таких условиях и обстоятельствах (для параметров процесса, режимов работы оборудования), которые имеютмаксимальные шансы вызвать отклонение процесса или несоответствие продукта по сравнению с идеальными условиями. Логика очень проста – если при таких условиях мы получаем качественный продукт, значит, гарантированно мы будем достигать качества внутри заданных диапазонов.
Повторная валидация/квалификация
Через заданные периоды эксплуатации (использования), каждый объект/процесс должны пройти повторную валидацию. Основная цель повторной валидации (ревалидации) – это получить подтверждения того, что объект/процесс продолжает находиться в валидном состоянии. Это полностью отражает логику GMP: «Для подтверждения качества продукта недостаточно провести валидацию в начале его жизненного цикла, необходимо обеспечить мониторинг и постоянное улучшение» (см. схему ниже).
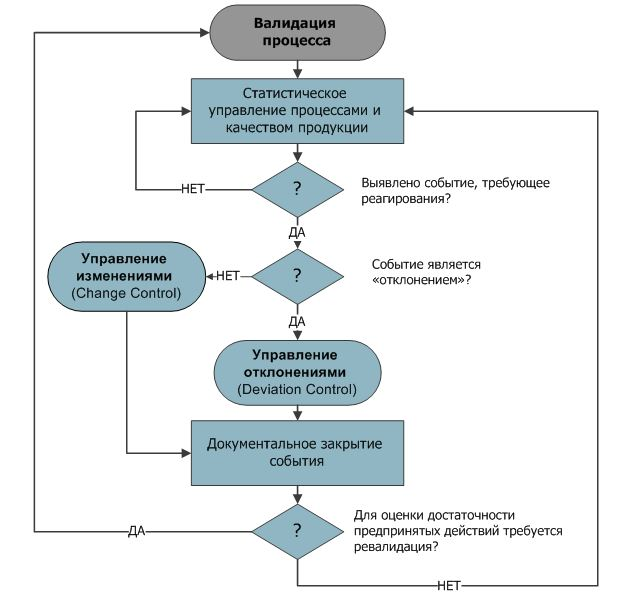
Схема – Надзор над валидированным объектом/процессом.
Рассматривается плановая и внеплановая ревалидация. Плановая – проводится по графику в соответствии с заранее установленной периодичностью (как правило, через 12-24 мес.). Внеплановая ревалидация – после длительных простоев, при появлении тренда отклонений или при внесении изменений.
Дата добавления: 2015-10-21; просмотров: 195 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Практика валидации процессов на примере фармацевтической отрасли. | | | ОСОБЕННОСТИ ВАЛИДАЦИОННЫХ ПРОЦЕССОВ В ПРОИЗВОДСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ. |