
Читайте также:
|
Уважаемый староста, я надеюсь, что данные примеры помогут студентам Вашей группы успешно справиться с заданием 1 по курсу химии.
Ваш лектор доцент кафедры ХиЭЭ О.Н. Гончарук
ПРИМЕРЫ ТИПОВЫХ ЗАДАЧ ПО ТЕМЕ
“СТРОЕНИЕ ВЕЩЕСТВА”
Пример. Используя метод ВС покажите образование связей в молекуле BeCl2, охарактеризуйте связи и молекулу в целом.
Решение.

■ sp -гибридизация АО Ве, Ð180о
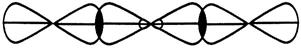 BeCl2
BeCl2
Cl Be Cl
■ коваленная сигма-связь, полярная m св ¹ 0, т.к. ∆ ЭО=1,5 (ЭО Ве =1,5; ЭО Cl= 3,0)
THORN; Cl Be ® Cl
■ mмол = Smсв = 0 Þ молекула в целом неполярная.
■ пространственная структура Þ линейная.
Пример. Укажите все виды межмолекулярных взаимодействий в системе из молекул PH3 и в системе NH3. Чем Вы объясните более высокую ТкипNH3?
Решение. Обе молекулы – полярны. Между молекулами РН3 – вандерваальсовы взаимодействия, между молекулами NH3 кроме вандерваальсовых взаимодействий действуют силы водородной межмолекулярной связи, следовательно, во втором случае для разрыва связей при фазовом переходе нужно приложить больше энергии, чем в первом и Ткип NH3 выше.
Пример. Какие межмолекулярные взаимодействия удерживают в жидкостях и молекулярных кристаллах следующие частицы Ar, CH4,. H2S, HBr, PН3.
Решение. Аргон, метан, сероводород, бромид водорода, фосфин – при обычных условиях газы, которые при охлаждении под давлением способны сжижаться и отвердевать. Межмолекулярные силы, заставляющие сжижаться и затвердевать метан, состоящий из неполярных молекул CH4 и силы, заставляющие сжижаться аргон, состоящий из одноатомных молекул Ar – дисперсионные. Поскольку три следующих газа состоят из полярных молекул (H2S, HBr, PH3), то переход в конденсированное состояние этих газов обусловлен действием всех ван-дер-ваальсовых сил (диполь-дипольных, индукционных, дисперсионных).
Дата добавления: 2015-10-13; просмотров: 142 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ПИШЕТСЯ ПОД КОНКРЕТНУЮ УСЛУГУ | | | УЧЕНИЕ СВОБОДЫ |