
Читайте также:
|
| Білок | Особливості структури | Властивості |
| Колаген сполучної тканини | Міцні поперечні зшивки між поліпептидними ланцюгами, молекулами і фібрилами, утворені лізином і водневі зв’язки. Щільна скрученість ланцюгів | Висока міцність |
| Еластин сполучної тканини | Поперечні зшивки між двома - чотирма ланцюгами і спіральні ділянки, багаті гліцином, здатні до зворотнього розтягування | Еластичне розтягування у всіх напрямках |
| a-кератини волосся, пір’я, нігтів | a-спіраль з поперечними дисульфідними зв’язками | Залежно від кількості поперечних зшивок структури різної твердості і гнучкості, міцні і водонерозчинні |
| b-кератини (фіброїн шовку і павутиння) | Складчатий шар | М’які, гнучкі нитки |
Скорочувальні білки. Вони формуються у фібрилярні структури, однак, основою їх будови є глобулярні молекули, розташовані вздовж нитчастої структури. Надходження енергії від енергопостачальних систем клітини приводить до зміни конформації молекул і зміни їх взаємного розташування, що проявляється у різноманітних рухах. Найкраще вивчені скорочувальні комплекси м’язових клітин. Вони складаються з білків двох типів - актину і міозину (рис. 5.8.). Актинові волокна побудовані так: глобулярні субодиниці (G-актин) укладаються поздовжньо у фібрилярну молекулу (F-актин). Дві такі молекули обвиваються одна навколо одної і утворюють тонкі нитки. G-актин містить досить багато проліну, 7 залишків цистеїну і рідкісну амінокислоту N-метиллізин. Субодиниці актину мають багато активних ділянок, які в стані розслаблення заблоковані спеціальними білками.
Молекули міозину мають дуже довгі "хвости", утворені двома поліпептидними ланцюгами, сплетеними між собою. Кінці цих ланцюгів сплітаються між собою і приєднують чотири невеликі глобулярні субодиниці, утворюючи “головку" молекули. В цій зоні розташована ділянка, яка здатна прикріпляти і розщеплювати молекулу АТФ для забезпечення енергією процесу скорочення. Відкриття цієї функції міозину, здійснене В. О. Енгельгардтом і М. М. Любімовою (1939 p.) було надзвичайно важливим для розуміння механізму м"язевого скорочення і енергетики біологічних процесів взагалі. Чисельні молекули міозину укладаються у товсті нитки, розташовуючись в них "хвіст" до "хвоста", причому їх "головки" утворюють вирости, спрямовані як вістря стріл в різні боки від центра нитки.
В м’язових фібрилах товсті і тонкі нитки укладені паралельно. В розслабленому стані вони не контактують між собою. Під дією рухового імпульсу в м’язовій клітині вивільнюються йони Са2+, які знаходились у зв’язаному стані. Активні ділянки актину у стані розслаблення блоковані певними білками. Йони Са2+, приєднуючись до цих білків, вивільняють активні ділянки актину. Йони Са2+ сприяють також розпаду АТФ і вивільненню продуктів розпаду в "головках" міозину. За рахунок енергії розпаду АТФ активовані ділянки актину і міозину з’єднуються. Контакт утворюється перпендикулярно до напряму фібрили, однак конформація білків в зоні контакту змінюється і утворений місток повертається на 45° з втягуванням актинової нитки між міозинові. При цьому посилюється спіральне скручування молекул і вкорочується фібрила. Далі до міозинової “головки” наближається нова активна ділянка актину. Таким чином, може утворитись новий контакт, тобто відбудеться дальше скорочення фібрили (рис. 5.9.). Після припинення імпульсу йони Са2+ знову зв’язуються в депо, на що також затрачається енергія АТФ. Зв’язки між актином і міозином у відсутність Са2+ порушуються і м’яз розслаблюється.
Транспортні білки утворюють комплекси з речовинами, які вони транспортують між тканинами або через мембрану. Ця функція та її регуляція найдосконаліше вивчена для дихальних білків - переносників кисню. Дихальні білки поширені починаючи від дріжджів і до вищих хребетних. В клубеньках бобових також знайдений дихальний білок. Всі вони зворотньо приєднують молекули кисню (зв’язують його при високому вмісті в.середовищі і віддають при пониженому). Дихальні білки містять йон заліза, рідше міді (молюски і більшість членистоногих), який бере участь у зв’язуванні кисню. Гемоглобіни і міоглобіни містять залізо (Fe2+) у складі небілкової частини – гему. Гем – це плоска система, яка складається з порфіринового кільця, утвореного чотирма пірольними гетероциклами, що містять замісники, та з’єднані між собою через метинові зшивки, і йону заліза:

Координаційні зв’язки заліза Гем
Йон заліза утворює чотири координаційні зв’язки з атомами азоту циклу і два зв’язки перпендикулярно площині циклу – один (Y) з білковою частиною (глобіном) через атом азоту радикалу гістидину і один (X) – з низькомолекулярним лігандом (в фізіологічних умовах це молекула кисню). Міоглобін складається з одного поліпептидного ланцюга і одного гему, а гемоглобін – з чотирьох субодиниць, попарно однакових (двох a- і двох b-), кожна з яких подібна за будовою до міоглобіну і зв’язана з гемом.
Відмінності у будові дихальних білків проявляються у молекулярній адаптації до їх специфічної ролі у газообміні.
Гемоглобін є білком еритроцитів. В легенях, де парціальний тиск кисню високий, гемоглобін циркулюючої крові зв’язує його. Молекула гемоглобіну (Hb) зв’язує максимально чотири молекули кисню. Процес відбувається поступово, причому перша молекула кисню приєднується повільно, а наступні - швидше:
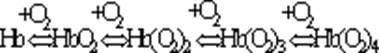
Це пояснюється зміною конформації молекули завдяки кооперативній взаємодії субодиниць. Ці зміни розмірів молекули проявляються у зменшенні простору між субодиницями. Тому гемоглобін називають “молекулярними легенями навпаки”, оскільки, як відомо, справжні легені при оксигенації розширюються. В капілярах тканин, де парціальний тиск кисню низький, оксигемоглобін дисоціює: Hb(O2)4 Û Hb + 4О2. Цей процес відбувається також поетапно.
Частина кисню, попадаючи в клітини, зв’язується з міоглобіном, який має значно більшу спорідненість до кисню, ніж гемоглобін (рис. 5.10.). Він насичується киснем при нижчому його парціальному тиску, ніж гемоглобін, і важче його віддає. Така відмінність в спорідненості до кисню між цими білками сприяє транспорту кисню від гемоглобіну до міоглобіну. Міоглобін створює резерв кисню в м’язах. У людей, які займаються інтенсивною фізичною працею, та у тварин, які ведуть активний спосіб життя, або перебувають в умовах недостатнього забезпечення киснем, м’язи мають темно-червоний колір, зумовлений високим вмістом міоглобіну.
Важливе фізіологічне значення має залежність функції гемоглобіну від кислотності середовища. Гемоглобін, зв’язуючи кисень, посилює кислотні властивості: HbH+ + O2 Û HbО2 + Н+
В кислому середовищі спорідненість гемоглобіну до кисню зменшується (рівновага в реакції зміщується в бік дисоціації оксигемоглобіну), тому він його легше віддає. Саме таке середовище створюється в тканинах, які працюють інтенсивно.
Виділення СО2 з клітин в кров підвищує її кислотність, а отже полегшує дисоціацію оксигемоглобіну.. Крім того, СО2 безпосередньо зв’язується з N-кінцевими аміногрупами гемоглобіну, вивільняючи при цьому протони:
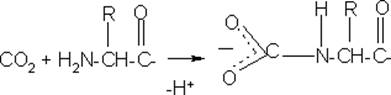
N-кінець молекули карбамінокінцевий залишок
Гемоглобін досить легко сполучається з таким лігандом як чадний газ CO і віддає його в 3600 разів повільніше, ніж кисень. Тому при отруєнні чадним газом необхідно посилювати оксигенацію крові, внаслідок чого буде посилюватись конкуренція з боку кисню за зв’язування.
Захисні білки – антитіла відіграють важливу роль в захисті організму від чужерідних речовин і клітин. Антитіла - це імуноглобуліни, які виробляються клітинами імунної системи лімфоцитами і входять до складу сироватки крові та інших позаклітинних рідин, а також поверхні деяких клітин, наприклад, лімфоцитів. Організм виробляє антитіла на чужерідні білки, полісахариди, інші речовини, наприклад, нітрофенол, на ракові клітини, пилок рослин тощо. Антитіла проявляють високу специфічність до свого антигена.
Молекула імуноглобулІну вивчена досить детально. Її будову з’ясували в 1961 p. Дж. Едельман і P. Портер, за що в 1972 p. були нагороджені Нобелівською премією. Молекула кожного імуноглобуліну представляє собою тетрамер, утворений чотирма попарно ідентичними ланцюгами - двома важкими (Н) і двома легкими (L), з’єднаними між собою дисульфідними містками. В обох типах ланцюгів є ділянки двох типів: константні (С), які мають однакову послідовність у різних імуноглобулінів, і варіабельні (V), послідовність яких істотно відрізняється:
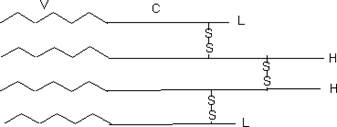
Варіабельні ділянки молекули визначають специфічність антитіл до певного антигену. У імуноглобулінів виражена доменна будова. Центри зв’язування антигену (А) (по два на молекулу антитіла) розташовані на ділянках VH i VL:
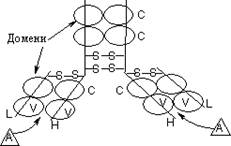
В зоні контакту переважають гідрофобні групи, тому вважають, що взаємодія має гідрофобний характер.
При взаємодії антитіл з антигенами утворюються дуже великі агрегати сітчастої будови, які руйнуються фагоцитами:

В нормі первинна дія імуноглобулінів повинна проявлятись вчасно, специфічно, адекватно за силою реакції і обмежено в часі. Однак, часто зустрічаються порушення мунної системи, які проявляються у гіперчутливості імунної реакції, або імунодефіцитності. Існують також захворювання, при яких імунна система організму починає працювати проти себе (аутоімунозахворювання). Порушення можуть виникати як наслідок дії радіоактивного опромінення, а також частого введення вакцин. На початку 80-х років було виявлено невиліковне на наш час захворювання - синдром набутого імунного дефіциту (СНІД). В 1984 р. з’ясували, що ця патологія викликається вірусом, який руйнує лімфоцити.
В наступному розділі ми розглянемо як реалізується ферментативна функція білків, а при вивченні обміну речовин охарактеризуємо їх енергетичну, регуляторну і рецепторну функції.
Для виявлення білків у різних матеріалах застосовують кольорові реакції, найвжливішими з яких є ксантопротеїнова і біуретова.
Ксантопротеїнова реакція. Твердий білок або його розчин під впливом концентрованої азотної кислоти при нагріванні жовтіє. Якщо до пожовтілого білка добавити розчин аміаку, то забарвлення переходить в оранжеве. Ксантропротеїнова реакція вказує на наявність у білковій молекулі бензольних ядер, отже, залишківароматичних сполук, які під впливом концентрованої кислоти утворюють продукти нітрування жовтого кольору.
Дана реакція характеризує наявність бензольних ядер, що входять до складу деяких амінокислот, наприклад, фенілаланіну:
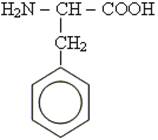
Біуретова реакція. При добавлені до водного розчину білка концентрованого лугу і кількох краплин розбавленого розчину CuSO4 з’являється фіолетове
Дана реакція характеризує наявність пептидних зв'язків:
-CO - NH-
Існують ще такі якісні реакції:
- Нінгідріновая реакція. 1% розчин мінгідріна в 95%-му розчині ацетону пробірки, колби, піпетка, водяна баня розчин білка;
- Реакція на тирозин (реакція Міллона). Реактив Міллона 4 пробірки; піпетки, спиртівка; зажим для пробірок розчин яєчного білка, міозину, желатину, тирозину;
- Реакція на цистеїн (реакція Фоля). 30% розчин NaOH; 5% розчин ацетату свинцю 3 пробірки; піпетки; спиртівка; зажим для пробірок розчин яєчного білка, міозину, желатину;
- Реакція на аргінін (реакція Сакануті). Кристалічний резорцин; 3% розчин H2O2; концентрована H2SO4 3 пробірки, піпетка, скляна ложечка. розчин яєчного білка, міозину, желатину;
- Реакція на гістидин та тирозин (реакція Паулі). 1% розчин сульфаніловой кислоти; 10% розчин NaNO2; 10% розчин Na2CO3 пробірка, піпетка, скляна паличка
розчин яєчного білка;
- Реакція на триптофан (реакція Адамкевіча). Крижана оцтова кислота; гліоксіловая кислота, концентрована H2SO4; пробірки; піпетка; скляна паличка, спиртівка; зажим для пробірок, лід. нерозбавлений яєчний білок;
- Реакція Вуазене. 2,5% розчин формальдегіду, концентрована HCl; 0,5% розчин NaNO2 пробірка; піпетка; скляна паличка розведений розчин білка;
- Нітропруссідная реакція. Насичений розчин (NH4) 2SO4; 5% розчин нитропрусида натрію; концентрований розчин аміаку пробірка, піпетка, скляна паличка
розчин білка.
Реакція Фоля.
Амінокислоти, що містять сульфгідрильні групи - SH, піддаються лужному гідролізу з утворенням сульфіду натрію Na2S. Останній, взаємодіючи з плюмбітом натрію (утворюється в ході реакції між ацетатом свинцю та NaOH), утворює осад сульфіду свинцю PbS чорного або бурого кольору.
Na2S + Na2PbO2 + 2H2O ® PbS ¯ + 4NaOH.
Реактиви: 1) яєчний білок, 1% р-р; 2) реактив Фоля (до 5%-р-ру ацетату свинцю додають рівний об'єм 30% розчину NaOH до розчинення утвореного осаду).
Реакція Міллона
Кольорова якостей. р-ція на білки і феноли. При додаванні до р-ру білка реактиву Міллона [р-р HgNO3 і Hg (NO3) 2 в разб. HNO3, містить домішка HNO2] утворюється білий осад денатурує. білка. При стоянні (швидше при нагр. До 50 ° С) осад забарвлюється спочатку в рожевий або жовтий, а потім у пурпурово-червоний колір. Червоне фарбування обумовлено утворенням ртутних солей нітрофенолу, завдяки присутності в білку залишків тирозину. Присутність в білку залишків триптофану дає буро-червоне забарвлення. Р-ції заважають аніони хлору, Н2О2, етанол, великі концентрації мінер. солей. Для приготування реактиву Міллона 40 г Hg розчин. при нагр. в 57 мл конц. HNO3, р-р розбавляють двома об'ємами води і рідину зливають з відстояного осаду. Р-ція запропонована Е. Міллона в 1849. BB Баєв.
Реакція Адамкевича
кольорова якісна реакція на триптофан і тріптофансодержащіе білки, заснована на фіолетово-синьому фарбуванні їх розчинів після додавання гліоксіловой і концентрованої сірчаної кислот.
Реакція Паула
Кольорова р-ція на білки, що містять залишки тирозину і (або) гістидину (а також на ці амінокислоти), яку здійснюють змішуванням розчину білка зі свіжо приготованим. р-ном n-діазобензолсульфокіслотой у присутності. Na2CO3. Синтез пофарбованого з’єднання відбувається в результаті р-ції азопоєднання, напр.:
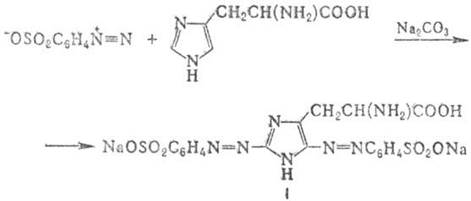
Утворені з’єднання I має в лужному середовищі червоне забарвлення, мінливу на жовто-червону при підкисленні. Р-ція неспецифічна, тому що в р-цію азопоєднання вступають мн. з’єднання, що містять в молекулі ароматіч. або гетероароматіч. цикл. П. Д. Решетов.
Реакція Вуазене
За допомогою цієї реакції відкривають наявність в білку амінокислоти - триптофан. Триптофан реагує з альдегідами в кислому середовищі з утворенням ок рашенних продуктів конденсації. З'являється інтенсивне синьо-фіолетове забарвлення.
Дата добавления: 2015-09-06; просмотров: 184 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Класи білків. Структурно-функціональна характеристика окремих представників | | | ПРИЕМ ДЕНЕЖНЫХ СРЕДСТВ НА СРОЧНЫЙ БАНКОВСКИЙ ВКЛАД «КЛАССИК ПЛЮС» В ИНОСТРАННОЙ ВАЛЮТЕ (В ДОЛЛАРАХ США, ЕВРО, РОССИЙСКИХ РУБЛЯХ) НАЧАТЬ С 1 ФЕВРАЛЯ 2012 Г. |