
|
Читайте также: |
ff®—<в)
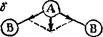
Рис. 30. Дипольные моменты отдельных свяаей в молекулах типа АВ2 различного строения;
я — линейное строение; б—угловое строение; жиркой средней стрелкой показан вектор суммарного дипольного момента молекулы.
Молекула тем более полярна, чем больше смещена общая электронная пара к одному из атомов, т. е. чем выше эффективные заряды атомов и чем больше длина диполя I. Поэтому в ряду сходно построенных молекул дипольный момент возрастает по мере увеличения разности электроотрицательностей атомов, образующих молекулу. Например, дипольные моменты НС1, НВг и HI равны соответственно 1,04; 0,79 и 0,38 D, что связано с уменьшением разности электроотрицательностей атомов при переходе от НС1 к НВг и HI (см. табл. 6).
Многоатомные молекулы также могут быть неполярными — при симметричном распределении зарядов или полярными — при асси- метричном распределении зарядов. В последнем случае дипольный момент молекулы будет отличаться от нуля. Каждой связи в многоатомной молекуле можно приписать определенный дипольный момент, характеризующий ее полярность; при этом следует принимать во внимание не только величину дипольного момента, по и его направление, т. е. рассматривать дипольный момент каждой связи как вектор. Тогда суммарный дипольный момент молекулы в целом можно считать равным векторной сумме диполь- ных моментов отдельных связей. Дипольный момент обычно принято считать направленным от положительного конца диполя к отрицательному.
|
Дипольные моменты молекул можно экспериментально определять путем измерения некоторых макроскопических свойств соответствующего вещества, например, его диэлектрической проницаемости [29]. Найденные таким образом значения дипольных моментов содержат важную информацию о геометрической структуре молекул.
Так, на рис. 30 изображены схемы возможного строения молекулы типа АВг; векторы дипольных моментов отдельных связей А—В показаны стрелками, направленными от А к В. При линейном строении (рис. 30, а) равные по величине дипольные моменты двух связей А—В противоположны по направлению. Следовательно, дипольный момент такой молекулы будет равен нулю. В случае углового строения (рис. 30,б) векторная сумма диполь- пых моментов двух связей А—В отличается от нуля; такая моле
кула обладает дипольным моментом и является полярной. Поэтому наличие или отсутствие дипольного момента у молекулы типа АВг позволяет сделать вывод о ее геометрическом строении. Например, то, что молекул? СОг неполярна, а молекула S02 обладает дипольным моментом (ц=1,61 D), свидетельствует о линейном строении первой молекулы и об угловом строении второй.
На рис. 31 изображены схемы возможного строения молекулы типа АВ3. Если молекула построена в форме плоского треугольника (рис. 31, а), то векторная сумма дипольных моментов отдельных связей равна нулю — молекула неполярна. Если молекула имеет пирамидальное строение (рис. 31,6), то ее суммарный ди- польный момент отличается от нуля — молекула полярна. Таким образом, можно сделать вывод, что молекула BF3, дипольный момент которой равен нулю, имеет плоское строение, а полярная молекула NH3 (ц — 1,46 D) построена в форме пирамиды *.
Полярность молекул оказывает заметное влияние на свойства образуемых ими веществ. Полярные молекулы стремятся ориентироваться по отношению друг к другу разноименно заряженными концами. Следствием такого диполь-дипольного взаимодействия является взаимное притяжение полярных молекул и упрочнение связи между ними. Поэтому вещества, образованные полярными молекулами, обладают, как правило, более высокими температурами плавления и кипения, чем вещества, молекулы которых не- лолярны.
При растворении вещества, состоящего из полярных молекул пли имеющего ионное строение, в жидкости, также составленной из полярных молекул, между молекулярными диполями растворителя и молекулами или кристаллами растворяемого вещества возникают электростатические силы диполь-дипольного или ион- дипольного взаимодействия, способствующие распаду растворяемого вещества на ионы (см. § 83). Поэтому жидкости, состоящие из полярных молекул, проявляют свойства ионизирующих растворителей, т.е. способствуют электролитической диссо-
 дипольного момента молекулы.
* Следует иметь в виду, что на величину дипольного момента молекулы влияет не только полярность отдельных связей и геометрическая структура молекулы, но и наличие неподеленных электронных пар на гибридных орбпталях (см. стр. 132—133).
дипольного момента молекулы.
* Следует иметь в виду, что на величину дипольного момента молекулы влияет не только полярность отдельных связей и геометрическая структура молекулы, но и наличие неподеленных электронных пар на гибридных орбпталях (см. стр. 132—133).
|
циацнн растворенных в них веществ. Так, хлороводород растворяется и в воде, и в бензоле, ко его растворы в воде хорошо проводят электрический ток, что свидетельствует о практически полной диссоциации молекул НС1 на ионы, тогда как растворы HG в бензоле не обладают заметной электрической проводимостью.
41. Способы образования ксвалентной связи. Как уже говорилось, общая электронная пара, осуществляющая ковалентную связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденных взаимодействующих атомах. Это происходит, например, при образовании таких молекул, как Н2, НС1, С12. Здесь каждый из атомов обладает одним неспаренным электроном; при взаимодействии двух таких атомов создается общая электронная пара — возникает ковалентная связь.
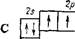
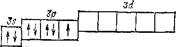
В невозбужденном атоме азота имеются три неспаренных электрона:
| as н | t | f | f |
Следовательно, за счет неспаренных электронов атом азота может участвовать в образовании трех ковалентных связей. Это и происходит, например, в молекулах N2 или NH3, в которых ковалентность азота равна 3.
|
Однако число ковалентных связей может быть и больше числа имеющихся у невозбужденного атома неспаренных электронов. Так, в нормальном состоянии внешний электронный слой атома углерода имеет структуру, которая изображается схемой:
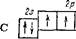
|
За счет имеющихся неспаренных электронов атом углерода может образовать две ковалентные связи. Между тем для углерода характерны соединения, в которых каждый его атом связан с соседними атомами четырьмя ковалентными связями (например, С02, СН4 и т. д.). Это оказывается возможным благодаря тому, что при затрате некоторой энергии можно один из имеющихся в атоме 2«-электронов перевести на подуровень 2р; в результате атом переходит в возбужденное состояние, а число неспаренных электронов возрастает. Такой процесс возбуждения, сопровождающийся «распариванием» электронов, может быть представлен следующей схемой, в которой возбужденное состояние отмечено звездочкой у символа элемента:
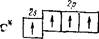
|
Теперь во внешнем электронном слое атома углерода находятся четыре неспаренных электрона; следовательно, возбужденный атом углерода может участвовать в образовании четырех ковалентных связей. При этом увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на перевод атома в возбужденное состояние.
Если возбуждение атома, приводящее к увеличению числа неспаренных электронов, связано с очень большими затратами энергии, то эти затраты не компенсируются энергией образования новый связей; тогда такой процессе целом оказывается энергетически невыгодным. Так, атомы кислорода и фтора не имеют свободных орбиталей во внешнем электронном слое:
| 2S tl | tl | tl | f |
| is tl | tl | f | t |
| О |
Здесь возрастание числа неспаренных электронов возможно только путем перевода одного из электронов на следующий энергетический уровень, т. е. в состояние 3s. Однако такой переход сопряжен с очень большой затратой энергии, которая не покрывается энергией, выделяющейся при возникновении новых связей. Поэтому за счет неспаренных электронов атом кислорода может образовать не больше двух ковалентных связей, а атом фтора — только одну. Действительно, для этих элементов характерна постоянная ковалентность, равная двум для кислорода и единице — для фтора.
Атомы элементов третьего и последующих периодов имеют во внешнем электронном слое d-подуровень, на который при возбуждении могут переходить s- и р-электроны внешнего слоя. Поэтому здесь появляются дополнительные возможности увеличения числа неспаренных электронов. Так, атом хлора, обладающий в иевоз- буждениом состоянии одним неспаренным электроном,
|
С1
может быть переведен, при затрате некоторой энергии, в возбужденные состояния (С! *), характеризующиеся тремя, пятью или семью неспаренными электронами;
3d
|
| 3S |
| 3d |
| Зр |
| 3S |
| t t t |
| tl 3d |
| Зр |
| t t t |
| t I t |
Поэтому, в отличие от атома фтора, атом хлора может участвовать в образовании не только одной, но также трех, пяти или семи ковалентных связей. Так, в хлористой кислоте НСЮ2 ковалент- ность хлора равна трем, в хлорноватой кислоте НСЮ3 — пяти, а в хлорной кислоте НСЮ4 — семи. Аналогично атом серы, также обладающий незанятым З^-подуровнем, может переходить в воз- бужденныеи состояния с четырьмя или шестью неспаренными электронами и участвовать, следовательно, в образовании не только двух, как у кислорода, но также четырех или шести ковалентных связей. Этим можно объяснить существование соединений, в которых сера проявляет ковалентность, равную четырем (SO2, SCU) или шести (SFg).
Во многих случаях ковалентные связи возникают и за счет спаренных электронов, имеющихся во внешнем электронном поле атома. Рассмотрим, например, электронную структуру молекулы аммиака:
Н х»
HxN
•X
Н
Здесь точками обозначены электроны, первоначально принадлежавшие атому азота, а крестиками — принадлежавшие атомам водорода. Из восьми внешних электронов атома азота шесть образуют три ковалентные связи и являются общими для атома азота и атомов водорода. Но два электрона принадлежат только азоту к образуют неподеленную электронную пару. Такая пара электронов тоже может участновать в образовании ковалентной связи с другим атомом, если во внешнем электронном слое этого атома есть свободная орбиталь. Незаполненная ls-орби- таль имеется, например, у иона водорода Н+, вообще лишенного электронов:
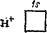
|
Поэтому при взаимодействии молекулы NH3 с ионом водорода между ними возникает ковалентиая связь; неподеленная пара электронов атома азота становится общей для двух атомов, в результате чего образуется ион аммония NH*:
| Н х- |
| г н х- |
| + |
| Н х N: + Н • х |
| Н х N: Н •X L н |
| Н |
Здесь ковалектная связь возникла за счет пары электронов, тронной пары), и свободной орбитали другого атома (а к цеп- первоначально принадлежавшей одному атому (донору элек^
тора электронной пары). Такой способ образования ковалентной связи называется донорно-акцепторным. В рассмотренном примере донором электронной пары служит атом азота, а акцептором — атом водорода.
Опытом установлено, что четыре связи N—Н в ионе аммония во всех отношениях равноценны. Из этого следует, что связь, образованная донорно-акцепторным способом, не отличается по своим свойствам от ковалентной связи, создаваемой за счет неспа- ренных электронов взаимодействующих атомов [30].
Другим примером молекулы, в которой имеются связи, образованные донорно-акцепторным способом, может служить молекула оксида азота(I) N20.
Раньше структурную формулу этого соединения изображали следующим образом:
0=Ns2M
Согласно этой формуле центральный атом азота соединен с соседними атомами пятью ковалентными связями, так что в его внешнем электронном слое находятся десять электронов (пять электронных пар). Но такой вывод противоречит электронной структуре атома азота, поскольку его наружный L-слой содержит всего четыре орбитали (одну s- и три р-орбитали) и не может вместить более восьми электронов. Поэтому приведенную структурную формулу нельзя признать правильной.
Рассмотрим электронную структуру оксида азота(I), причем электроны отдельных атомов будем попеременно обозначать точками или крестиками. Атом кислорода, имеющий два неспаренных электрона, образует две ковалентных связи с центральным атомом азота:
хх
< х
О: V N х
За счет неспаренного электрона, оставшегося у центрального атома азота, последний образует ковалентную связь со вторым атомом азота;
" уХХУ "
О: у N. N • • • •
Таким образом, внешние электронные слои атома кислорода и центрального атома азота оказываются заполненными: здесь образуются устойчивые восьмиэлектронные конфигурации. Но во внешнем электронном слое крайнего атома азота размещено только шесть электронов; этот атом может, следовательно, быть акцептором еще одной электронной пары. Соседний же с ним центральный атом азота обладает неподеленной электронной парой и может выступать в качестве донора. Зто приводит к образованию по донорно-акцепторному способу еще одной ковалентной связи между атомами азота:
Теперь каждый из трех атомов, составляющих молекулу N20, обладает устойчивой восьмкэлектронной структурой внешнего слоя. Если ковалентную связь, образованную донорко-акцепторным способом, обозначить, как это принято, стрелкой, направленной о г атома-донора к атому-акцептору, то структурную формулу оксида азота (I) можно представить следующим образом:
0=N=>N
Таким образом, в оксиде азота(I) ковалентность центрального атома азота равна четырем, а крайнего — двум.
Рассмотренные примеры показывают, что атомы обладают разнообразными возможностями для образования ковалентных связей. Последние могут создаваться и за счет неспаренных электронов невозбужденного атома, и за счет неспаренных электронов, появляющихся в результате возбуждения атома («распаривания» электронных пар), и, наконец, по донорно-акцепторному способу. Тем не менее, общее число ковалентных связей, которые способен образовать данный атом, ограничено. Оно определяется общим числом валентных орбиталей, т. е. тех орбиталей, использование которых для образования ковалентных связей оказывается энергетически выгодным. Квантово-механический расчет показывает, что к подобным орбиталям принадлежат s- и р-орбитали внешнего электронного слоя и d-орбитали предшествующего слоя; в некоторых случаях, как мы видели на примерах атомов хлора и серы, в качестве валентных орбиталей могут использоваться и d-орбп- тали внешнего слоя.
Атомы всех элементов второго периода имеют во внешнем электронном слое четыре орбитали при отсутствии с?-орбиталей в предыдущем слое. Следовательно, на валентных орбиталях этих атомов может разместиться не более восьми электронов. Это означает, что максимальная ковалентность элементов второго периода равна четырем.
Атомы элементов третьего и последующих периодов могут использовать для образования ковалентных связей не только s- и р-, но также и af-орбитали. Известны соединения ^-элементов, в которых в образовании ковалентных связей участвуют s- и р-орбитали внешнего электронного слоя и все пять ейзрбиталей предшествующего слоя; в подобных случаях ковалентность соответствующего элемента достигает девяти.
Способность атомов участвовать в образовании ограниченного числа ковалентных связей получила название насыщаемости ковалентной связи.
42. Направленность ковалентной связи. Свойства молекулы, ее способность вступать в химическое взаимодействие с другими молекулами (реакционная способность) зависят не только от прочности химических связей в молекуле, но в значительной мере и от ее пространственного строения. Раздел химии, изучающий геометрическую структуру молекул, их пространственное строение, называется с т е р е о х и м и е й.
Выше (§ 39) уже говорилось, что образование ковалентной связи является результатом перекрывания валентных электронных облаков взаимодействующих атомов. Но такое перекрывание возможно только при определенной взаимной ориентации электронных облаков; при этом область перекрывания располагается в определенном направлении по отношению к взаимодействующим атомам. Иначе говоря, ковалентная связь обладает направленностью.
Так, в молекуле водорода (рис. 27) перекрывание атомных s-электронных облаков происходит Еблизи прямой, соединяющей ядра взаимодействующих атомов (т. е. вблизи оси связи). Образованная подобным образом ковалентная связь называется а-связыо (с и г м a - с в я з ь).
В образовании а-связи могут принимать участие и р-электрон- ные облака, ориентировнные вдоль оси связи. Так, в молекуле HF (рис. 32) ковалентная сг-связь возникает вследствие перекрывания ls-электронного облака атома водорода и 2р-электронного облака атома фтора. Химическая связь в молекуле F2 (рис. 33) тоже а-связь; она образована 2р-электронными облаками двух атомов фтора.
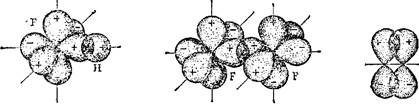 Рис. 32. Схема перекрывания 2/>-электронного облака атома фто^а и ls-электронного облака атома водорода при образовании О-связи в молекуле HF:
+ и — знаки волновой функции.
Рис. 32. Схема перекрывания 2/>-электронного облака атома фто^а и ls-электронного облака атома водорода при образовании О-связи в молекуле HF:
+ и — знаки волновой функции.
|
| Рис. 33. Схема перекрывания 2/»-злектгонных облаков атомов фтора при образовании 0-связи в молекуле F2- |
| Рис. 34. Схема перекрывания р-электронных облаков при образовании я-связи. |
При взаимодействии /^-электронных облаков, ориентированных перпендикулярно оси связи (рис. 34), образуется не одна, а две области перекрывания, расположенные по обе стороны от этой оси. Такая ковалентная связь называется it-связью (пи- связь).
Рассмотрим образование молекулы азота N2. Каждый атом азота обладает тремя неспаренными 2р-электронами, электронные облака которых ориентированы в трех взаимно перпендикулярных направлениях. ?
| t | ||||
| ft | ||||
На рис. 35 изображено перекрывание р-электронных облаков в молекуле N2 (для удобства изображения перекрывание рх~, р - рг-облаков показано раздельно). Как показывает рис. 35, атомы азота связаны в молекуле N2 тремя ковалентными связями. Но эти связи неравноценны: одна из них с-связь, а две другие я-связи. Вывод о неравноценности связей в молекуле азота подтверждается тем, что энергия их разрыва различна.
Представление о направленности ковалентных связей позволяет объяснить взаимное расположение атомов в многоатомных молекулах. Так, при образовании молекулы воды электронные облака двух неспаренных 2р-электронов атома кислорода перекрываются с ls-электронными облаками двух атомов водорода; схема этого перекрывания изображена на рис. 36. Поскольку р-электрон- ные облака атома кислорода ориентированы во взаимно перпендикулярных направлениях, то молекула Н20 имеет, как показано на рис. 36, угловое строение, причем можно ожидать, что угол между связями О—Н будет составлять 90°.
Молекула NH3, образующаяся при взаимодействии трех р-элек- тронов атома азота с s-электронами трех атомов водорода (рис.37), имеет структуру пирамиды, в вершине которой находится атом азота, а в вершинах основания атомы водорода. И в этом случае
можно ожидать, что углы между связями N—Н будут равны 90°.


| Рис. 33. Схема перекрывания 2р-электронных облаков в молекуле N2: а—-а-связь; 6 и е — п-сцязи. |
| - ч, -jFV > ay ^ |
Эти выводы о взаимном расположении атомов в молекулах NH3 и Н20 соответствуют действительности. Значительная по-
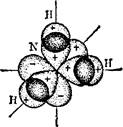
|
Рис, 36. Схема образования химических связей в молекуле воды. Рис. 37. Схема образования химических связей в молекуле аммиака.
лярность молекул воды (ц = 1,84 D) и аммиака (ц — 1,48 D), а также данные структурных исследований свидетельствуют о том, что молекула Н20 имеет угловое строение, а молекула NH3 построена в форме пирамиды. Однако углы между связями (валентные углы) отличаются от 90°: в молекуле воды угол НОН составляет 104,5°, а в молекуле аммиака угол HNH равен 107,3°.
Для объяснения отличия валентных углов в молекулах Н20 и NH3 от 90° следует принять во внимание, что устойчивому состоянию молекулы отвечает такая ее геометрическая структура и такое пространственное расположение электронных облаков внешних оболочек атомов, которым отвечает наименьшая потенциальная энергия молекулы. Это приводит к тому, что при образовании молекулы формы и взаимное расположение атомных электронных облаков изменяются по сравнению с их формами и взаимным расположением в свободных атомах. В результате достигается более полное перекрывание валентных электронных облаков и, следовательно, образование более прочных ковалентных связей. В рамках метода валентных связей такая перестройка электронной структуры атома рассматривается на основе представления о гибридизации атомных орбиталей.

|
43. Гибридизация атомных электронных орбиталей. Метод гибридизации атомных орбиталей исходит из предположения, что при образовании молекулы вместо исходных атомных s-, р- и d-элек- тронных облаков образуются такие равноценные «смешанные» или гибридные электронные облака, которые вытянуты по направлению к соседним атомам, благодаря чему достигается их более полное перекрывание с электронными облаками этих атомов. Такая деформация электронных облаков требует затраты энергии. Но более полное перекрывание валентных электронных облаков приводит к образованию более прочной химической связи и, следовательно, к дополнительному выигрышу энергии. Если этот выигрыш энергии достаточен, чтобы с избытком скомпенсировать затраты энергии на деформацию исходных атомных электронных облаков, такая гибридизация приводит, в конечном счёте,
к уменьшению потенциальной энергии образующейся молекулы и, следовательно, к повышению ее устойчивости.
| Ji!*4 |
| Бе |
Рассмотрим в качестве примера гибридизации образование молекулы фторида бериллия BeF2. Каждый атом фтора, входящий в состав этой молекулы, обладает одним неспаренным электроном,
2/>
н н
который и участвует в образовании ковалентной связи. Атом бериллия в невозбужденном состоянии (ls22s2) неспаренных электронов не имеет:
2р
Е
Поэтому для участия в образовании химических связей атом бериллия должен перейти в возбужденное состояние (ls22s12p1):
| Be* |
гр
| US f | t | ||
Образовавшийся возбужденный атом Be* обладает двумя нс- спаренными электронами: электронное облако одного из них соответствует состоянию 2s, другого — 2р. При перекрывании этих электронных облаков с р-электронными облаками двух атомов фтора могут образоваться ковалентные связи (рис. 38).
Однако, как уже было сказано, при затрате некоторой энергии вместо исходных s- и р-орбиталей атома бериллия могут образоваться две равноценные гибридные орбитали (sp-орбитали). Форма и расположение этих орбиталей показаны на рис. 39, из которого видно, что гибридные sp-орбитали вытянуты в противоположных направлениях.
Перекрывание гибридных яр-электронных облаков атома бериллия с р-электронными облаками атомов фтора изображено на
 Рис. 38. Схема перекрывания 2/?-электронны:* облаков атомов фтора с 2s- и 2/?-электронным и эблаками атома бериллия (для каждой связи отдельно).
Рис. 38. Схема перекрывания 2/?-электронны:* облаков атомов фтора с 2s- и 2/?-электронным и эблаками атома бериллия (для каждой связи отдельно).
|
Области перекрывания электронных облаков заштрихованы.
Рис. 39. Форма (схематическое изображение) и взаимное расположение гибридных sp электронных облаков атома бериллия (для каждой гибридной орбитали отдельно}*
Рис. 40. Схема образования химических связей в мо
лекуле ВеГ;!.
В целях упрощения рисунка гибридные яр-электрон ные облака атома бериллия изображены неполностью
рис. 40. Благодаря вытянутой форме гибридных орбиталей достигается более полное перекрывание взаимодействующих электронных облаков, а значит, образуются более прочные химические связи. Энергия, выделяющаяся при образовании этих связей, больше, чем суммарные затраты энергии на возбуждение атома бериллия и гибридизацию его атомных орбиталей. Поэтому процесс образования молекулы BeF2 энергетически выгоден.
Рассмотренный случай гибридизации одной s- и одной р-орби- тали, приводящий к образованию двух sp-орбиталей, называется sp-r и б р и д и з а ц и е й. Как показывает рис. 39, sp-орбитали ориентированы в противоположных направлениях, что приводит к линейному строению молекулы. Действительно, молекула BeF2 линейна, а обе связи Be—F в этой молекуле во всех отношениях равноценны.
Возможны и другие случаи гибридизации атомных орбиталей, однако число образующихся гибридных орбиталей всегда равно общему числу исходных атомных орбиталей, участвующих в гибридизации. Так, при гибридизации одной s- и двух р-орбиталей (sp2-г ибридизация — читается «эс-пэ-два») образуются три равноценные 5р2-орбитали. В этом случае гибридные электронные облака располагаются в направлениях, лежащих в одной плоскости и ориентированных под углами 120° друг к другу (рис. 41). Очевидно, что этому типу гибридизации соответствует образование плоской треугольной молекулы.
Примером молекулы, в которой осуществляется «р2-гибридиза- ция, может служить молекула фторида бора BF3. Здесь вместо исходных одной s- и двух р-орбиталей возбужденного атома бора
| 2s t | t | t | |
образуются три равноценные sp2-орбитали. Поэтому молекула BF3 построена в форме правильного треугольника, в центре которого расположен атом бора, а в вершинах — атомы фтора. Все три связи В—F в молекуле BF3 равноценны.
Если в гибридизации участвуют одна s- и три р-орбитали (sp3 - г и б р и д и з а ц и я), то в результате образуются четыре гибридные sp3-орбитали, вытянутые в направлениях к вершинам тетраэдра, т. е. ориентированные под углами 109°28' друг к другу (рис. 42). Такая гибридизация осуществляется, например, в возбужденном атоме углерода при образовании молекулы метана
Дата добавления: 2015-08-21; просмотров: 328 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| IV И СТРОЕНИЕ МОЛЕКУЛ 1 страница | | | IV И СТРОЕНИЕ МОЛЕКУЛ 3 страница |