
Читайте также:
|
Возбудитель чумы – Yersinia pestis относится к высокопатогенным микроорганизмам (1 группы патогенности). Взятие, доставка материала при подозрении на чуму и работа с ним производятся в специализированных лабораториях с соблюдением особых правил предосторожности (в противочумном костюме, с применением специальных средств и устройств, предотвращающих попадание микроорганизма на кожу, слизистые оболочки и в дыхательные пути медицинского персонала, а также на различные объекты внешней среды).
В зависимости от способа заражения различают бубонную, легочную, кишечную формы, реже возникает септическая и кожная формы. Материал, подлежащий исследованию на чуму (см. схему 4), помещают в банки, которые герметично закрывают, обрабатывают снаружи 5% раствором лизола, наклеивают этикетку с указанием вида материала, даты и места его взятия, фамилии и инициалов больного, а также диагноза. Банки плотно укладывают в герметичную тару, на крышке которой указывают «Верх»; в банку вкладывают опись направляемых на исследование материалов. Материалы подлежат немедленной отправке в лабораторию на специальном транспорте с сопровождающим лицом. Перед исследованием тара с материалом и другие потенциально зараженные предметы обрабатываются дезинфицирующим раствором.
Лица, контактировавшие с материалом, подозрительным на содержание возбудителя чумы, подвергаются полной санитарной обработке.
Принципы микробиологической диагностики чумы отражены в схеме 4.
Бактериоскопический метод. Мазки, приготовленные из исследуемого материала, фиксируют в смеси Никифорова, окрашивают по Граму и метиленовым синим. С целью экспресс-диагностики мазки обрабатывают также меченой люминесцирующей сывороткой к Y. pestis (прямой ИФМ). Предварительный положительный ответ выдается в случае обнаружения в мазках биполярно окрашенных грамотрицательных овоидных бактерий, окруженных нежной капсулой (рис.7), дающих специфическое свечение в РИФ.
В качестве других методов экспресс-диагностики чумы применяют РНГА с иммуноглобулиновым чумным диагностикумом, ИФА для индикации антигенов возбудителя.
Методы ускоренной и экспресс-диагностики дают возможность дать предварительный ответ через 4 ч от начала исследования, окончательный - через 18-20 ч.
Бактериологическое исследование. Кровь при подозрении на чуму засевают на МПБ во флаконах; содержимое бубона, отделяемое язвы, мокроту и другой материал — на МПА с цельной или гемолизированной кровью кролика или лошади в чашках Петри с антифаговой сывороткой для нейтрализации чумного фага, раствором генцианового фиолетового и сульфита натрия для подавления роста посторонней микрофлоры, находящейся в исследуемом материале. Применяют также селективную среду с антибиотиками — агар CIN. Посевы инкубируют при 25—28 °С. Через 16—20 ч на чашках под малым увеличением микроскопа обнаруживают рост колоний в виде скоплений осколков битого стекла, которые к 48 ч приобретают вид R-формы с компактным приподнятым центром и ажурной полупрозрачной периферией («кружевные платочки» - рис. 8). На поверхности МПБ через 24 ч образуется рыхлая пленка, от которой спускаются тяжи, напоминающие сталактиты.
Схема 4. Микробиологическая диагностика чумы
| ||
|



|
А б
Рис. 7. Возбудитель чумы(Yersinia pestis). а - чистая культура, окраска метиленовым синим. Палочки овоидной формы, окрашенные биполярно.х 630. б – мазок из материала от больного, окраска по Граму. Грамотрицательные, биполярно окрашенные, капсулообразующие палочки овоидной формы. х1350
Типичные колонии пересевают на скошенный МПА, чистую культуру чумных бактерий идентифицируют по морфологическим, культуральным, ферментативным, антигенным свойствам (РА с использованием диагностических сывороток против высокоспецифичного капсульного и соматического антигенов), фаголизабельности, определяют ее чувствительность к антибиотикам. Возбудитель чумы восстанавливает нитраты в нитриты, ферментирует глюкозу, ксилозу, маннит с образованием кислоты (без газа). В отличие от многих других представителей семейства энтеробактерий имеет более низкий температурный оптимум роста и физиологической активности - 28 °С. В процессе идентификации возбудитель чумы необходимо дифференцировать с другими иерсиниями (табл. 6).
Биологическое исследование. Заражают морских свинок или мышей подкожно, внутрибрюшинно или накожно, материалом от трупов – методом скарификации.
Животные погибают на 2—7-е сутки. Одно из зараженных животных умерщвляют на 2—3-й день с целью выделения культуры иерсиний из крови и внутренних органов. В мазках из внутренних органов, крови, экссудата погибших животных обнаруживают большое количество грамотрицательных, биполярно окрашенных бактерий. После исследования трупы животных погружают в 5% лизол, а затем сжигают.
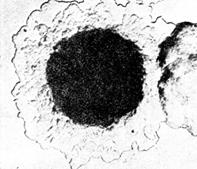
Рис. 8. Колонии возбудителя чумы (Yersinia pestis). х56
Таблица 6. Биологические свойства иерсиний
| Свойства | Y. pestis | Y. pseudotuberculosis | Y. enterocolitica |
| Подвижность при: 250 С 28-370 С | - - | + - | + - |
| Ферментация: рамнозы раффинозы инозита мочевины сахарозы | - - - - - | + + - + - | - - + + + |
| уреаза орнитиндекарбоксилаза | - - | - - | + - |
| Фракция 1 | + | - | - |
| Мышиный токсин | + | - | - |
| Пестицин 1 | + | - | - |
| Плазмокоагулаза | + | - | - |
| Фибринолизин | + | - | - |
| Чувствительность к чумному фагу | + | - | - |
| Вирулентная форма колоний | R | S | S |
Серологическое исследование проводится с целью ретроспективной диагностики чумы. Ставят РНГА с эритроцитами, на которых адсорбирован капсульный антиген возбудителя чумы, реакцию нейтрализации антигена (РНАг), ИФА и непрямую РИФ. Диагностический титр 1:40 и выше.
Генодиагностика. Разработана ПЦР для экспресс-диагностики чумы.
Дата добавления: 2015-09-03; просмотров: 98 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Микробиологическая диагностика столбняка. | | | Микробиологическая диагностика туляремии |