
|
Читайте также: |
Если привести в соприкосновение два раствора с разными концентрациями, то молекулы будут диффундировать преимущественно в том направлении, где их концентрация ниже. Двусторонняя диффузия приведет к выравниванию концентраций.
Диффузия может стать односторонней, если растворы разделить полупроницаемой перегородкой, пропускающей только молекулы растворителя. Такая односторонняя диффузия растворителя через полупроницаемую перегородку называется осмосом.
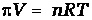 или
или  .Откуда
.Откуда 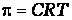 ,где π-осмотическое давление; С – молярная концентрация раствора.
,где π-осмотическое давление; С – молярная концентрация раствора.
| Законы | Неэлектролиты | Электролиты |
| Законы Рауля | 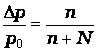
| 
|

| 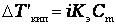
| |

| 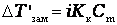
| |
| Закон Вант-Гоффа | 
| 
|
Здесь 
Активность. Законы Рауля и Вант-Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов. По мере повышения концентрации растворенного вещества возрастают отклонения от законов идеальных растворов. Эти отклонения обусловлены различного рода взаимодействиями между частицами растворенного вещества, растворенного вещества и растворителя. Поэтому для учета этих взаимодействий в законы идеальных растворов было предложено ввести вместо концентраций компонентов активности. Активность а связана с концентрацией соотношением
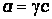 ,
,
где 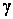 - коэффициент активности, формально учитывает взаимодействия частиц в растворе, приводящие к отклонению от свойств идеального раствора.
- коэффициент активности, формально учитывает взаимодействия частиц в растворе, приводящие к отклонению от свойств идеального раствора.
Коэффициент активности вычисляют по экспериментальным данным. Для этого измеряют какое-либо свойство раствора и определяют коэффициент активности как частное от деления экспериментально полученной величины на теоретическирассчитанную по законам идеальных растворов:
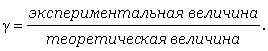
Итак, общие свойства растворов выражаются законами Рауля и Вант-Гоффа. В реальных растворах вместо концентрации используется активность.
Дата добавления: 2015-09-03; просмотров: 64 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Закон Рауля | | | Чёрный миф о "кровавом палаче" Берии |