
|
Читайте также: |
РЕФЕРАТ
Пояснительная записка к курсовому проекту: 29 с., 8 рис., 8 табл.,
7 лит. ист.
В общей части обсуждены современные методы концентрирования водных растворов. Принята однокорпусная выпарная установка для концентрирования 0,95 т/час водного раствора КCl от начальной концентрации 10% масc. до конечной 30% масс. Выбраны основные технологические параметры процесса выпаривания. Определены материальные и тепловые потоки системы.
Принята конструкция конденсатора смешения. На основании технологического расчета определены геометрические размеры аппарата, обеспечивающую заданную тепловую нагрузку. Выбраны основные конструктивные элементы аппарата.
УСТАНОВКА, ВЫПАРКА, КОНДЕНСАТОР БАРОМЕТРИЧЕСКИЙ, РАСЧЕТ, ТЕХНОЛОГИЯ.
ОГЛАВЛЕНИЕ
стр.
ВВЕДЕНИЕ 5
1 ОБЩАЯ ЧАСТЬ 7
1.1 Теоретические основы процесса 7
1.2 Описание технологической схемы установки 10
1.3 Описание конструкции барометрического конденсатора 12
2 ТЕХНОЛОГИЧЕСКИЙ РАСЧЕТ 14
2.1 Материальный баланс установки 14
2.2 Расчет температуры кипения раствора 14
2.3 Расчет тепловой нагрузки выпарного аппарата 16
2.4 Расчет тепловой нагрузки подогревателя исходного раствора 17
2.5 Расчет количества охлаждающей воды в барометрическом конденсаторе. 18
3 КОНСТРУКТИВНЫЙ РАСЧЕТ 19
3.1 Расчет диаметра корпуса барометрического конденсатора 19
3.2 Расчет высоты барометрической трубы 20
3.3 Расчет полок конденсатора 22
3.4 Расчет диаметра основных штуцеров 23
3.5 Выбор фланцевых соединений 25
3.6 Выбор днища и крышки аппарата 27
ПЕРЕЧЕНЬ ССЫЛОК 29
ВВЕДЕНИЕ
Выпаривается раствор хлорида калия. Соли калия нашли широчайшее распространение в природе они в свободном виде находятся как в минералах так и в воде. Самый распространенный минерал сильвинит, или хлорид калия КCl. Хлористый калий известен с давних времен, его добывают из руды, состоящей из смеси сильвина, и галита или карналита.
Хлористый калий нашел широкое применение как в промышленности так и в народном хозяйстве. В промышленности хлорид калий используют как исходное вещество в производстве различных металлических добавок, различных неорганических солей содержащих калий, также он нашел применение в производстве комплексных соединений, красителей и взрывчатых веществ. Еще его используют в производстве поташа, едкого калия, цианистого калия.
Хлорид калия получается путем растворения рудного концентрата в воде, затем раствор фильтруют, но чаще всего для дальнейшего применения необходим водный раствор более высокой концентрации, или вообще безводная соль, поэтому полученную смесь подвергают концентрированию различными методами.
В данном проекте предложено концентрировать водный раствор хлорида калия путем его выпаривания в однокорпусной выпарной установке.
В таблице приведены основные физико-химические свойства хлорида калия. [1]
Физико-химические свойства хлористого калия
| Формула | КCl |
| Название | Хлорид калия |
| Молекулярная масса, кг/моль | 74,56 |
| Плотность, кг/м3 | |
| Температура плавления, 0К | |
| Температура кипения, 0К | |
| Растворимость в воде при 200С | 34,0 |
| Растворимость в воде при 1000С | 56,7 |
ОБЩАЯ ЧАСТЬ
Теоретические основы процесса
Выпаривание используется для концентрирования растворов твердых веществ (водные растворы щелочей, солей и др.), а также высококипящих жидкостей, которые при температуре выпаривания имеют сравнительно малое давление насыщенных паров, некоторые минеральные и органические кислоты, многоатомные спирты и др.
По своей сути, выпаривание – процесс концентрирования растворов твердых нелетучих веществ путем удаления жидкого летучего растворителя в виде паров. Сущность выпаривания заключается в переводе растворителя в парообразное состояние и отводе полученного пара от оставшегося сконцентрированного раствора. Выпаривание обычно проводится при кипении, т.е., в условиях, когда давление пара над раствором равно давлению в рабочем объеме аппарата.
Процесс выпаривания относится к числу широко распространенных. Последние объясняется тем, что многие вещества, например едкий натр, аммиачная селитра, хлористый магний и др., получают в виде разбавленных водных растворов, а на дальнейшую переработку и транспорт они должны поступать в виде концентрированных продуктов.
К свойствам растворов, имеющим значение для процессов выпаривания, относятся температурная депрессия, теплоемкость, и теплота растворения.
Как известно, при одной и той же температуре Т давление паров над чистым растворителем Ра больше, чем давление над раствором Рв - рис. 2.1, и соответственно при одном и том же давлении температура кипения растворителя ниже температуры кипения раствора. Разность между температурами кипения раствора и растворителя Тв – Та =  называется температурной депрессией.
называется температурной депрессией.
Для определения температурной депрессии неконцентрированных растворов недиссоциирующих веществ может быть использовано основное уравнение эбуллиоскопии:

где 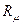 - универсальная газовая постоянная, кДж/(кмоль ∙ 0С);
- универсальная газовая постоянная, кДж/(кмоль ∙ 0С);
 - температура кипения, 0С;
- температура кипения, 0С;
r- теплота испарения растворителя, кДж/кг;
с- концентрация растворенного вещества, кмоль/кмоль;
Определяя депрессию для диссоциирующихся растворенных веществ, в правую часть равенства вводят сомножитель i, выражающий отношение общего числа частиц, получающихся в результате диссоциации, к исходному числу частиц растворяемого вещества.
Температурная депрессия для концентрированных растворов может быть определена по уравнению:
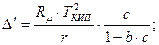
где b - константа определяемая опытным путем.
Обычно температурную депрессию не вычисляют, а находят по соответствующим таблицам, составленных на основании опытных данных.
Пар, образующийся над кипящим раствором, называется вторичным паром. Практически в результате взаимодействия насыщенного пара с брызгами кипящего раствора его температура оказывается выше, чем температура растворителя при заданном давлении. Однако при анализе процессов выпаривания допускают, что температура вторичного пара равна температуре насыщенного пара растворителя при заданном давлении.
При растворении твердых веществ, если они не реагируют с растворителем, наблюдается охлаждение раствора, так как разрушается кристаллическая решетка, а на это требуется затрата энергии (теплота плавления). Если же растворяемое вещество вступает в химическую реакцию с растворителем, образуя сольваты, при растворении в воде - гидраты, то за счет этого выделяется тепло. Теплота растворения представляет собой сумму теплот плавления и химического взаимодействия. Интегральной теплотой растворения называют количество тепла, поглощающегося или выделяющегося при растворении 1кг твердого вещества (или раствора, в котором содержится 1кг твердого вещества) в очень большом количестве растворителя, т.е. в таком количестве, что дальнейшее его прибавление практически не сопровождается тепловым эффектом.
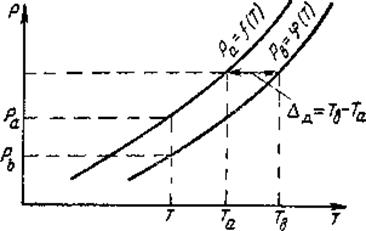
Рисунок 1.1 - Определение температурной депрессии
Для анализа процессов выпаривания необходимо знать теплоту изменения концентрации раствора  , которая легко определяется по интегральной теплоте растворения.
, которая легко определяется по интегральной теплоте растворения.
Пусть известны интегральная теплота растворения q1 раствора с концентрацией х1 и интегральная теплота растворения q2 раствора с концентрацией х2. На основании закона Гесса (тепловой эффект превращения зависит только от начального и конечного состояния системы, но не зависит от пути, по которому превращение протекает) для рассматриваемого случая можно записать: 
 или
или 
Тепло  выделяется при разбавлении раствора от концентрации х2 до х1 и поглощается при концентрировании раствора от концентрации х1
выделяется при разбавлении раствора от концентрации х2 до х1 и поглощается при концентрировании раствора от концентрации х1
до х2.
В химической технике используются следующие основные способы выпаривания: простое выпаривание (однокорпусная установка), проводимое как непрерывным, так и периодическим методами, многократное выпаривание (многокорпусные установки), осуществляемое только непрерывно, и выпаривание с применением теплового насоса. Два последних способа проведения процесса обеспечивают экономию тепла и поэтому имеют преобладающее значение.
Все перечисленные способы проводят как под давлением, так и под вакуумом, в зависимости от параметров греющего пара и свойств выпариваемых растворов. [2]
1.2 Описание технологической схемы установки
В данном проекте рассматривается однокорпусная прямоточная выпарная установка для выпаривания хлористого калия, представлена на
рис. 1.2.
Исходный раствор из емкости Е1 насосами Н1,2 подается в подогреватель Т, где нагревается до температуры, близкой к кипению за счет конденсации в межтрубном пространстве греющего пара, подогреватель представляет собой кожухотрубчатый теплообменник.


Подогретый раствор поступает в выпарной аппарат АВ, где за счет конденсации греющего пара в межтрубном пространстве греющей камеры происходит выпаривание раствора до заданной концентрации, упаренный раствор самотеком поступает в емкость Е2, и насосами Н3 подается потребителю.
Вторичный пар поступает в нижнюю часть барометрического конденсатора КБ, где поднимаясь вверх, противоточно взаимодействует с охлаждающей водой, конденсируется, и по барометрической трубе отводится в канализацию. Образовавшиеся в ходе конденсации газы отводятся в атмосферу при помощи вакуум насоса ВН.
Дата добавления: 2015-10-23; просмотров: 249 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Пример оформления рисунков | | | Расчет температуры кипения раствора |