
|
Читайте также: |
Белки: определение, свойства, строение, классификация. Характеристика пептидной связи. Простые и сложные белки. Биологическая роль белков.
Белки – это высокомолекулярные азотсодержащие органические вещества, состоящие из аминокислот, соединённых в цепи с помощью пептидных связей и имеющих сложную структурную организацию.
Биологическая роль белков:
1. каталитическая (выполняют ферменты);
2. структурная, т.е. белки являются основным компонентом клеточных структур;
3. регуляторная (выполняют белки-гормоны);
4. рецепторная, т.е. рецепторы клеточных мембран имеют белковую природу;
5. транспортная – белки участвуют в транспорте липидов, токсических веществ, кислорода и т.д.;
6. опорная – выполняет белок коллаген;
7. энергетическая. Заключается в том, что при окислении 1г белка выделяется 17,6 кДж (4,1ккал) энергии;
8. сократительная – её выполняют белки актин и миозин;
9. генно-регуляторная – её выполняют белки гистоны, участвуя в регуляции репликации;
10. имуннологическая – её выполняют белки антитела;
11. гемостатическая – участвуют в свёртывании крови, препятствуют кровотечению;
·антитоксическая, т.е. белки связывают многие токсические вещества (особенно соли тяжёлых металлов) и препятствуют развитию интоксикации в организме.
Физико-химические свойства белков:
Структура белка определяет его свойства. Существует несколько групп свойств.
I. Электрохимические свойства белков:
1. белки - амфотерные полиэлектролиты (амфолиты). Это достигается за счет наличия концевых СОО- и NH3+ групп, а также ионогенных групп боковых радикалов (ГЛУ, АСП, ЛИЗ, АРГ, ГИС)
2. буферность белков (поддержка рН среды). При физиологических значениях рН буферные свойства ограничены и обусловлены наличием кислотных и основных групп. Наибольшим буферным действием обладает гистидин, которого много в гемоглобине, за счет чего последний является мощным буфером крови;
3. наличие заряда в белковой молекуле. Обусловлено соотношением кислых и основных АК, а также ионизацией бокового радикала. Степень ионизации зависит от рН среды. Так, если среда кислая, то ионизация СООН групп заторможена и белок приобретает «+» заряд. В щелочной среде заторможена ионизация NH 2 групп и белок заряжается «--».
II. Коллоидные свойства.
Растворы белков чаще всего достаточно устойчивы. Хорошая растворимость приближает растворы белков к истинным растворам, но высокая молекулярная масса придает им свойства коллоидных систем
III. Гидрофильные свойства.
Белки хорошо связываются водой, обусловлено наличием полярных гидрофильных групп. Вода может проникать в белок и связываться с его гидрофильными группами, вызывая его набухание. Также возможно образование гидратной оболочки. 100г белка связывают 30-35г воды.
IV. Растворимость белков.
Чем больше полярных групп содержит белок, тем больше он растворим. Глобулярные белки растворяются лучше. Растворимость белков зависит от 2-х факторов:
- наличия заряда;
- образования гидратной оболочки.
V. Денатурация.
Под действием внешних факторов нарушается высшие уровни (вторичный, третичный, четвертичный) структурной организации белков с сохранением первичной структуры. При этом белок теряет свои нативные свойства. При денатурации разрываются связи, удерживающие высшие структурные организации.
Классификация белков:
В настоящее время насчитывается ~5 млн. белков. Их пытались классифицировать по физико-химическим свойствам, например по растворимости, плотности, форме молекул (глобулярные и фибриллярные), локализации и происхождению, АК-составу, биологической роли. Однако все эти классификации не соответствуют тем знаниям о белках, которые известны на сегодняшний день.
В основе классификации лежит химический состав белка. По этому признаку все белки делят на простые и сложные.
Простые белки – это белки, образованные только полипептидными цепями, состоящие только из АК-ных остатков.
Сложные белки имеют две части: белковая или пептидная построена из АК-ных остатков, и небелковая (простетическая) часть.
К простым белкам относят: гистоны, протамины, альбумины, глобулины, глютелины, проламины и протеноиды (склеропротеины).
К сложным белкам относят: хромопротеины, нуклеопротеины, фосфопротеины, углевод-белковые и липид-белковые комплексы.
Связь белковой части с небелковой может быть ковалентной, ионной и др.
Характеристика сложных белков
Они имеют белковую и небелковую (простетическую) части. Белковую часть составляет полипептид, построенный из АК-остатков. В состав небелковой части может входить: гем, металл, остаток фосфорной кислоты, углеводы, липиды и т.д.
Пептидная связь - это соединение карбоксильной группы одной аминокислоты с аминогруппой другой аминокислоты.
По структуре молекулы белков представляют собой цепи, построенные из аминокислот. Карбоксильные группы одной аминокислоты, – COOH и аминогруппа другой аминокислоты, – NH2 могут соединяться. Каждое такое соединение называют пептидной связью, компоненты пептидной связи называют аминокислотными остатками, а получившееся при соединении двух и более аминокислот вещество называют пептидом.
2 Уровни структурной организации белка.
Выделяют четыре уровня структурной организации белков: первичный, вторичный, третичный и четвертичный.
Первичная структура белка
Первичной структурой белков называется линейная полипептидная цепь из аминокислот, соединенных между собой пептидными связями. Первичная структура - простейший уровень структурной организации белковой молекулы. Высокую стабильность ей придают ковалентные пептидные связи между α-аминогруппой одной аминокислоты и α-карбоксильной группой другой аминокислоты
Вторичная структура представляет собой способ укладки полипептидной цепи в упорядоченную структуру благодаря образованию водородных связей между пептидными группами одной цепи или смежными полипептидными цепями. По конфигурации вторичные структуры делятся на спиральные (α-спираль) и слоисто-складчатые (β-структура и кросс-β-форма).
Третичной структурой белка называется способ укладки полипептидной цепи в пространстве. По форме третичной структуры белки делятся в основном на глобулярные и фибриллярные. Глобулярные белки чаще всего имеют эллипсовидную форму, а фибриллярные (нитевидные) белки — вытянутую (форма палочки, веретена).
Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру. К ним относятся миоглобин — белок мышечной ткани, участвующий в связывании кислорода, ряд ферментов (лизоцим, пепсин, трипсин и т. д.). Однако некоторые белки построены из нескольких полипептидных цепей, каждая из которых имеет третичную структуру. Для таких белков введено понятие четвертичной структуры, которая представляет собой организацию нескольких полипептидных цепей с третичной структурой в единую функциональную молекулу белка. Такой белок с четвертичной структурой называется олигомером, а его полипептидные цепи с третичной структурой — протомерами или субъединицами
Химическая природа ферментов. Строение простых и сложных ферментов. Кофакторы и коферменты. Функционально активные центры ферментов.
Ферменты – это биологические катализаторы белковой природы. В одной клетке до 10 тыс. молекул фермента, которые катализируют 2000 ферментативных реакций. 1800 тыс. ферментов выделены, но их строение не расшифровано. Старое название ферментов – энзимы, а наука, их изучающая – энзимология.
По своей химической природе ферменты – это белки, они имеют несколько уровней структурной организации и обладают всеми другими свойствами белков. Очень большое количество ферментов не имеют 4-ую структуру, т.е. являются олигомерами.
Ферменты могут быть простыми и сложными. Простые состоят только из полипептидной цепи, а сложные имеют пептидную (апофермент) и небелковую части (кофермент). Далее идёт рис. [апофермент+кофермент=холофермент – обладает полноценной функциональной активностью]. По отдельности ни апофермент, ни кофермент, не выполняют функции так, как холофермент.
Строение ферментов. В пространственной структуре фермента условно выделяют ряд участков, которые выполняют соответствующие им функции. Активный центр (АЦ) – участок в молекуле фермента, где происходит связывание и химическое превращение субстрата (S). Субстрат – вещество, подвергающееся химическому превращению (например, для фермента лактатдегидрогеназы (ЛДГ) субстратом будет молочная кислота). В активном центре выделяется контактный участок и каталитический участок. Контактный участок – это место активного центра, в котором происходит связывание фермента с субстратом по принципу комплементарности, т.е. именно контактный участок обеспечивает специфическое сродство субстрата ферменту. Образовавшийся комплекс носит название фермент-субстратный комплекс.
Механизм действия ферментов
Молекулярные эффекты действия ферментов
1) Эффект концентрирования – это адсорбирование на поверхности молекулы фермента молекул реагирующих веществ, т.е. субстрата, что приводит к их лучшему взаимодействию. Пр.: электростатическое притяжение – скорость реакции может возрасти в 103 раз.
2) Эффект ориентации – это специфическое связывание субстрата с контактными участками активного центра фермента, которое обеспечивает взаимную ориентацию молекул субстрата и их сближение для более выгодного воздействия каталитических групп в активном центре. За счет эффекта ориентации скорость реакции возрастает в 103-104 раз. [рис. эффекта ориентации: поворот двух кругов вырезами друг к другу]
3) Эффект натяжения (теория «дыбы»). Субстрат до присоединения к ферменту находится в расслабленной конформации, а после связывания с ферментом деформируется или растягивается. Места деформации легче атакуются каталитическим центром фермента. [рис. эффекта дыбы: субстрат растягивается над ферментом]
4) Эффект вынужденного соответствия (прилегания). Не только субстрат претерпевает изменение конформации, но и фермент, особенно в активном центре, после связывания субстрата меняет свою конформацию, которая становится более комплементарной субстрату.
Теория Фишера: фермент подходит к субстрату как ключ к замку.
Теория Котланда: фермент и субстрат взаимодействуют между собой по принципу рука–перчатка. Истинная комплементарность фермента к субстрату достигается после изменения конформации и субстрата и фермента.
Специфичность действия ферментов. Виды специфичности.
Различают два главных вида специфичности ферментов: субстратную специфичность и специфичность действия.
Субстратная специфичность, это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента.
Различают 3 типа субстратной специфичности:
·абсолютная субстратная специфичность - это способность фермента катализировать превращение только одного, строго определенного субстрата;
·относительная субстратная специфичность - способность фермента катализировать превращения нескольких, сходных по строению, субстратов;
·стереоспецифичность - способность фермента катализировать превращения определенных стереоизомеров.
Например, фермент оксидаза L-аминокислот способен окислять все аминокислоты, но относящиеся только к L-ряду. Таким образом, этот фермент обладает относительной субстратной специфичностью и стереоспецифичностью одновременно.
Специфичность действия - это способность фермента катализировать только определенный тип химической реакции.
В соответствии со специфичностью действия все ферменты делятся на 6 классов. Классы ферментов обозначаются латинскими цифрами. Название каждого класса ферментов соответствует этой цифре.
Регуляция активности ферментов. Путь их активации и ингибирования.
Ферменты являются регулируемыми катализаторами. В качестве регуляторов могут выступать метаболиты, яды. Различают:
- активаторы – вещества, увеличивающие скорость реакции;
- ингибиторы – вещества, уменьшающие скорость реакции.
Активация ферментов. Различные активаторы могут связываться либо с активным центром фермента, либо вне его. К группе активаторов, влияющих на активный центр, относятся: ионы металла, коферменты, сами субстраты.
Активация с помощью металлов протекает по различным механизмам:
- металл входит в состав каталитического участка активного центра;
- металл с субстратом образуют комплекс;
- за счет металла образуется мости между субстратом и активным центром фермента.
Субстраты также являются активаторами. При увеличении концентрации субстрата скорость реакции повышается. по достижению концентрации насыщения субстрата эта скорость не изменяется.
Ингибирование ферментов. Ингибитор – это вещество, вызывающее специфическое снижение активности фермента. Следует различать ингибирование и инактивацию. Инактивация – это, например, денатурация белка в результате действия денатурирующих агентов.
По прочности связывания ингибитора с ферментом ингибиторы делят на обратимые и необратимые.
Необратимые ингибиторы прочно связаны и разрушают функциональные группы молекулы фермента, которые необходимы для проявления его каталитической активности. Все процедуры по очистке белка не влияют на связь ингибитора и фермента. Пр.: действие фосфорорганических соединений на фермент – холинэстеразу. Хлорофос, зарин, зоман и др. фосфорорганические соединения связываются с активным центром холинэстеразы. В результате происходит фосфорилирование каталитических групп активного центра фермента. В следствии молекулы фермента, связанные с ингибитором, не могут связываться с субстратом и наступает тяжелое отравление.
Также выделяют обратимые игнибиторы, например прозерин для холинэстеразы. Обратимое ингибирование зависит от концентрации субстрата и ингибитора и снимается избытком субстрата.
По механизму действия выделяют:
- конкурентное ингибирование;
- неконкурентное ингибирование;
- субстратное ингибирование;
- аллостерическое.
Медицинская энзимология, энзимопатии и энзимодиагностика.
Энзимология (энзимы + греч. logos учение) — раздел биохимии, посвященный изучению строения, механизма каталитического действия и молекулярной структуры ферментов. Энзимология занимается решением проблемы очистки и препаративного выделения ферментов, их классификацией, изучением кинетики ферментативного катализа (Кинетика биологических процессов), специфичности, ингибирования и активации ферментов, исследованием их кофакторов (Коферменты), а также процесса биосинтеза ферментов, их биологии, практического применения, в т. ч. для энзимодиагностики (Ферменты) и энзимотерапии. Энзимология тесно связана с химией, физической химией, биоорганической химией, биофизической химией, молекулярной биологией, микробиологией, генетикой, фармакологией, токсикологией, физиологией, биофизикой, биотехнологией (т. 29, доп. материалы) и хим. технологией. Энзимология и медицина. Недостаточность тех или иных ферментов вызывает в организме отклонения от физиол. нормы, получившие название энзимопатии.
Энзимопатии по предложению А. А.
Покровского делят на:
1) наследственные, при которых синтез какого-либо фермента не происходит вообще или протекает с недостаточной интенсивностью или фермент синтезируется неактивным, потому что нарушено образование активного фермента из его профермента либо холофермента из ферментного белка (апофермента) и простетической группы (кофермента) ит. д.;
2) токсические, возникающие при избирательном ингибировании отдельных ферментов, при специфическом экзогенном избирательном торможении биосинтеза отдельных ферментов или общем угнетении биосинтеза белков;
3) алиментарные, развивающиеся нри витаминной недостаточности, нехватке белка, микроэлементов или при несбалансированном питании (Питание);
4) энзимопатии, вызванные нарушением нейрогуморальной регуляции;
5). энзимопатии, связанные с нарушением внутриклеточной организации ферментативных процессов.
Величина активности ряда ферментов (ок. 40) в крови, моче, фибробластах, эритроцитах и др. является важным диагностическим тестом. Изменение активности ферментов при патол. состояниях может быть либо причиной заболевания (энзимопатия), либо его следствием. Кроме того, многие ферменты используются как хим. реактивы для определения составных частей тканей и жидкостей организма, напр., уреазу применяют при количественном определении мочевины, глюкозооксидазу — для определения глюкозы в моче и крови (Городецкого методы), холинэстеразу используют для определения остаточных количеств фосфор органических соединений, в т. ч. ив биологических субстратах.
Ферменты все шире применяют в качестве лекарственных средств. Энзимология изучает их фармакол. свойства, разрабатывает методы иммобилизации ферментов на нейтральных носителях и др. В фармакотерапии возрастает роль ферментных препаратов на основе иммобилизованных ферментов (стрептокиназы, стрептодеказы и др.), а также ферментов, вводимых в организм с помощью липосом. Ферментные препараты используют для возмещения дефицита ферментов при заместительной терапии; напр., при некоторых формах гастрита назначают пищеварительные ферменты желудка и поджелудочной железы. Протеолитические ферменты (Пептид-гидролазы) применяют при лечении гнойно-воспалительных заболеваний или тромбозов. Однако при лечении наследственных энзимопатии (Наследственные болезни) ферментные препараты пока неэффективны.
Биологическое окисление. Характеристика ферментов и коферментов.
Ферменты, катализирующие окислительновосстановительные реакции, называют оксидоредуктазами. Их разделяют на 5 групп.
1) Оксидазы. Истинные оксидазы катализируют удаление водорода из субстрата, используя при этом в качестве акцептора водорода только кислород. Они неизменно содержат медь, продуктом реакции является вода (исключение составляют реакции, катализируемые уриказой и моноаминоксидазой, в результате которых образуется.
2) Аэробные дегидрогеназы—ферменты, катализирующие удаление водорода из субстрата; в отличие от оксидаз они могут использовать в качестве акцептора водорода не только кислород, но и искусственные акцепторы, такие, как метиленовый синий. Эти дегидрогеназы относятся к флавопротеинам, и продуктом катализируемой ими реакции является перекись водорода, а не вода.
Анаэробные дегидрогеназы—ферменты, ката-, лизирующие удаление водорода из субстрата, но не способные использовать кислород в качестве акцептора водорода. В этот класс входит большое число ферментов. Они выполняют две главные функции.
Электронно-транспортная цепь. Строение, механизм действия.
В многоэтапной цепи реакций дыхания происходит постепенное, ступенчатое высвобождение энергии органических веществ и закрепление ее в молекулах АТФ. Эта энергия используется на процессы биосинтеза, поддержания структуры клеток, рост, поглощение и передвижение веществ и другие нужды растений. Постепенность высвобождения энергии способствует более полному ее использованию на указанные процессы с высоким КПД.
Дыхание является сложным окислительно-восстановительным процессом. Вместе с кислородом, который участвует только в последних этапах дыхания, активное участие принимает водород. Именно процесс дегидрирования (отщепления водорода от органического вещества) и перенос электронов составляет основу процесса дыхания. В большинстве реакций кислород не участвует, то есть процесс дыхания не аналогичен горению, когда вся энергия рассеивается в виде тепла.
При окислении веществ происходит потеря ими протонов и электронов. В живой клетке акцепторов протонов и электронов много. Если последним акцептором протонов протонов и электронов служит кислород, то это дыхание, если органическое вещество – брожение.
Процесс дыхания подразделяют на внешний (поглощение кислорода и выделение углекислого газа) – газообмен, и внутренний (сложные биохимические реакции, результат которых – постепенное высвобождение энергии органических веществ и закрепление ее в АТФ.
Схема работы дыхательной цепи митохондрий
ЭТЦ– это передача электронов от восстановленных субстратов на кислород, сопровождаемая переносом через мембрану ионов Н+, или окислительно-восстановительная водородная помпа.
Окисление НАД и ФАД происходит в электронно-транспортной цепи (ЭТЦ) митохондрий. В результате работы ЭТЦ протоны и электроны передаются на конечный акцептор – кислород с образованием воды:
4Н+ + 4е + О2= 2Н2О
Вода – второй конечный продукт дыхания. Энергия окисления НАДхН2и ФАДхН2аккумулируется в АТФ. Ферменты цикла Кребса расположены в матриксе митохондрий. Общее полное уравнение процесса дыхания:
С6Н12О6 + 6О2+ 6Н2О + 38АДФ + 38Н3РО4 = 6СО2 + 12Н2О + 38АТФ
Общая схема брожения
В анаэробных условиях у растений происходит диссимиляция по типу спиртового брожения. При этом затрачивается во много раз больше органических веществ, чем при дыхании, при этом образуются ядовитые вещества (ацетальдегид, этанол). Поэтому без кислорода растения истощаются и отравляются. Спиртовое брожение широко распространено у микроорганизмов, например у дрожжей (сумчатые грибы). Они хорошо переносят анааэробные условия, но размножаются только в аэробной среде.
Первый этап сбраживания дрожжами глюкозы аналогичен гликолизу. Образующаяся ПВК под действием ферментов распадается на ацетальдегид, который восстанавливается до этанола, и молекулу углекислого газа.
Роль кислорода в обеспечении организма энергией.
Кислород - наиболее распространенный в окружающей среде химический элемент. Он составляет 89% массы воды, 23% массы воздуха и около 50% массы природных минералов.
Животные и растения получают необходимую для жизни энергию за счет биологического окисления различных веществ кислородом, поступающим в организмы при дыхании.
Наиболее эффективно обеспечение живых организмов кислородом и использование его в окислительно-восстановительных процессах происходит в тех случаях, когда содержание кислорода в воздухе, который поглощают живые организмы, составляет 20,8% (лучше - при несколько более высоком содержании: на 0,5-1,0%).
Роль кислорода для здоровья человека. Кислород:повышает умственную работоспособность;повышает устойчивость организма к стрессам и повышенным нервным нагрузкам;поддерживает уровень кислорода в крови;улучшает согласованность работы внутренних органов;повышает иммунитет;способствует снижению веса. Регулярное потребление кислорода в сочетании с двигательной активностью, приводит к активному расщеплению жиров;нормализуется сон: он становится более глубоким и продолжительным, уменьшается период засыпания и двигательной активности
Проблема кислородной задолженности (гипоксии)
К сожалению, требуемое для здоровья человека содержание кислорода в наше время в природных условиях реализуется лишь в городских парках (20,8%), загородных лесах (21,6%) и на берегах морей и океанов (21,9%). В то же время, в городских помещениях (квартирах и офисах) содержание кислорода в воздухе значительно меньше (20%), что приводит к возникновению у людейкислородной недостаточности (гипоксии).
Ситуацию усугубляет выбрасываемый промышленностью и автомобильным транспортом угарный газ (СО), который является конкурентом кислорода за связывание с гемоглобином крови. Накапливаясь в атмосфере воздуха городов, он еще сильнее затрудняет усвоение кислорода организмом. Дело в том, что СО (угарный газ) в 200 раз быстрее связывается с гемоглобином (транспортным средством для кислорода), то есть в 200 раз быстрее занимает место молекул кислорода. Эксперименты, проведенные в США, показали, что у водителей, проводящих большое количество времени за рулем, нарушаются реакции элементарно необходимые для управления автомобилем.
Механизм окислительного фосфорилирования (теория Митчелла).
Перенос электронов по дыхательной цепи приводит к выбросу протонов в межмембранное пространство из митохондриального матрикса. В результате матрикс защелачивается, а межмембранное пространство - закисляется.
Такой градиент, при котором концентрация Н больше в межмембранном пространстве, чем внутри митохондрий, обладает потенциальной энергией. Хемиосмотическая гипотеза Митчелла и Скулачева постулирует далее, что ионы Н из межмембранного пространства устремляются внутрь в митохондриальный матрикс, через специальные каналы в молекулах F0F1 - АТФ-азы. В этом случае они перемещаются по концентрации и во время их перехода через молекулы АТФ-азы выделяется свободная энергия. Именно эта энергия и служит движущей силой для сопряженного синтеза АТФ из АДФ и фосфата. Эта модель требует, чтобы:
1. Переносчики протонов и АТФ-аза работали векторно, т.е. чтобы они были определенным образом ориентированы по отношению к двум поверхностям мембраны.
2. Внутренняя мембрана была совершенно непроницаема для протонов, поскольку для протонного градиента необходимо наличие замкнутого компартамента.
Основной смысл предложенного механизма состоит в том, что первым запасающим энергию актом является перенос протонов через внутреннюю митохондриальную мембрану.
Гипотеза Митчелла о сопряжении окисления и фосфорилирования протонным градиентом получила в настоящее время множество подтверждений.
АТФ-синтаза или F0F1- АТФ-синтаза, ферментативная система, встроенная во внутреннюю мембрану митохондрий состоит из двух главных компонентов. F1-напоминает круглую дверную ручку, обращенную грибовидным выростом в матриксе и обладающий способностью синтезировать АТФ из АДФ и ФН.
12 Переваривание и всасывание в желудочно-кишечном тракте. Переваривание и всасывание углеводов
Основными пищевыми углеводами являются крахмал, гликоген, а также дисахариды - лактоза, сахароза, мальтоза. Их переваривание заключается в расщеплении поли-, олиго- и дисахаридов до моносахаридов под влиянием ферментов-гликозидаз желудочно-кишечного тракта.
Переваривание крахмала начинается уже в ротовой полости под влиянием амилазы слюны. Однако в основном его гидролиз с образованием фрагментов крахмала - декстринов - происходит в тонком кишечнике под действием а-амилазы поджелудочной железы (амило-1,4-гликозидазы):
Крахмал -» декстрины -> олигосахариды -» мальтоза + изомальтоза
Образующиеся мальтоза и изомальтоза, а также другие дисахариды, поступающие с пищей, гидролизуются специфическими энзимами-гликозидазами на поверхности ворсинок кишечных клеток:
Мальтоза —> 2 а-глюкоза; фермент-.мальтоза (а-1,4-гликозидаза), Изомальтоза —> 2 а-глюкоза; фермент - изомалыпаза (а-1,6-гликозидаза), Сахароза -» а-глюкоза + Р-фруктоза; фермент - сахароза, Лактоза -» а-глюкоза + р-галактоза; фермент - лактоза.
Глюкоза, галактоза и фруктоза попадают в клетки кишечника и далее в кровь путем облегченной диффузии, с участием специальных переносчиков. Глюкоза и галактоза могут всасываться и с помощью активного транспорта (симпорт моносахарщНМа+) с затратой энергии АТФ; этот механизм позволяет транспортировать моносахариды и против градиента концентрации, если их содержание в полости кишечника невелико.
Перенос глюкозы из крови в клетки большинства тканей зависит от гормона поджелудочной железы инсулина, который контролирует работу
ембранных ферментов-переносчиков. Исключение составляют два органа • печень и мозг; скорость поступления глюкозы в их клетки зависит только от ее концентрации в крови.
13 Метаболизм гликогена. Гликогеновые болезни 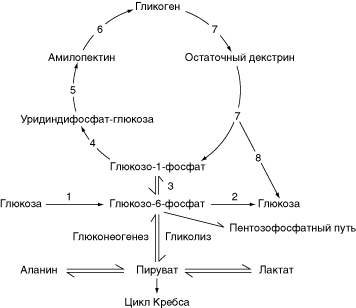 Упрощенная схема метаболизма гликогена. 1 — гексокиназа (глюкокиназа), 2 — глюкозо-6-фосфатаза, 3 — фосфоглюкомутаза, 4 — глюкозо-1-фосфат-уридилилтрансфераза, 5 — гликогенсинтетаза, 6 — 1,4-альфа-глюкан-ветвящий фермент, 7 — фосфорилаза, 8 — амило-1,6-глюкозидаза.
Упрощенная схема метаболизма гликогена. 1 — гексокиназа (глюкокиназа), 2 — глюкозо-6-фосфатаза, 3 — фосфоглюкомутаза, 4 — глюкозо-1-фосфат-уридилилтрансфераза, 5 — гликогенсинтетаза, 6 — 1,4-альфа-глюкан-ветвящий фермент, 7 — фосфорилаза, 8 — амило-1,6-глюкозидаза.
1. Синтез гликогена. Исходное вещество для синтеза гликогена — глюкозо-6-фосфат. Глюкозо-6-фосфат образуется главным образом из глюкозы путем ее фосфорилирования. В печени, мышцах и других тканях эту реакцию катализирует гексокиназа. В печени имеется особая форма гексокиназы — глюкокиназа, которая вступает в действие только при сильном повышении концентрации глюкозы в крови. Глюкозо-6-фосфат может синтезироваться и из неуглеводных субстратов глюконеогенеза (лактата, пирувата, аминокислот). В мышцах глюкозо-6-фосфат синтезируется преимущественно из глюкозы крови. Печень способна к интенсивному глюконеогенезу, особенно после мышечной работы, когда в крови накапливается много лактата. Глюкозо-6-фосфат превращается в глюкозо-1-фосфат, из которого синтезируются цепи гликогена. Образование альфа-1,4-связей катализирует гликогенсинтетаза; для образования альфа-1,6-связей необходим1,4-альфа-глюкан-ветвящий фермент.
Глюкозо-6-фосфат превращается не только в гликоген. В печени при гидролизе глюкозо-6-фосфата образуется глюкоза. Эта реакция катализируется глюкозо-6-фосфатазой. Другие пути метаболизма глюкозо-6-фосфата: гликолиз (при этом образуются пируват и лактат) и пентозофосфатный путь (при этом образуется рибозо-5-фосфат). В норме между всеми процессами метаболизма глюкозо-6-фосфата поддерживается равновесие.
2. Расщепление гликогена (гликогенолиз) включает несколько этапов. Сначалафосфорилаза последовательно отщепляет остатки глюкозы от концов боковых цепей гликогена. При этом фосфорилируются альфа-1,4-связи и образуются молекулыглюкозо-1-фосфата. Фосфорилаза атакует боковую цепь до тех пор, пока не дойдет до точки, отстоящей на 4 остатка глюкозы от места ветвления (т. е. от альфа-1,6-связи). Затем вступает в действие система отщепления боковых цепей гликогена. Первый фермент этой системы — 4-альфа-D-глюканотрансфераза — отщепляет 3 из 4 остатков глюкозы и переносит их на свободный конец другой боковой цепи. Второй фермент —амило-1,6-глюкозидаза —отщепляет от главной цепи четвертый остаток глюкозы. После этого главная цепь гликогена становится доступной для фосфорилазы. В реакции, катализируемой амило-1,6-глюкозидазой, образуется глюкоза. У здоровых людей при голодании до 8% гликогена печени расщепляется амило-1,6-глюкозидазой до глюкозы, а 92% гликогена расщепляется фосфорилазой до глюкозо-1-фосфата. Под действиемфосфоглюкомутазыглюкозо-1-фосфат превращается в глюкозо-6-фосфат, при гидролизе которого в печени образуется глюкоза, поступающая в кровь. Таким образом, основное количество глюкозы при голодании образуется в печени из глюкозо-6-фосфата.
Дата добавления: 2015-10-24; просмотров: 680 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Глава тринадцатая. Под контролем | | | Анаэробный распад углеводов. Гликолиз (схема процесса), его значение. |