
Читайте также:
|
Питання до семінару
1. У чому полягає суть періодичного закону Д.І.Менделєєва?
2. Чому з безперервним збільшенням заряду ядра властивості елементів у періодичній системі змінюються періодично?
3. Квантово – механічні уявлення про будову атома. В чому полягає фізична суть квантових чисел?
4. Які з наведених нижче підрівнів мають більшу енергію в парі:
а) 5s і 4d;
б) 5р і 6р;
в) 3d і 4s.
5. Обчисліть, чому дорівнює сумарний спін електронів:
а) в шести електронах на d – підрівні;
б) у двох електронів на р – підрівні;
в) у семи електронів на s – підрівні.
6. Керуючись правилом Клечковського і періодичною системою Д.І.Менделєєва, вкажіть нейтральним атомам яких елементів відповідають такі електронні формули:
а) 1s22s22p63s23p63d14s2;
б)s22s22p63s23p63d104s24p2;
в)1s22s22p63s23p63d54s1;
г)1s22s22p63s23p63d104s24p6;
д)1s22s22p6.
7. Складіть електронні формули таких іонів: нітрогену (5+),
сульфуру(4+), хрому (6+), арсену (- 3), хлору (-1), сульфуру (-2).
8. Поясніть, чому існують іони Н—, Cl—, але не існують іони He—, Ne—.
9. Запишіть схему електронної структури атомів паладію, хрому,молібдену. Яка особливість будови цих атомів?
10. Що таке енергія іонізації? Які з наведених елементів мають більшу енергію іонізації?
а) елемент №19 чи елемент № 37;
б) елемент № 11 чи елемент № 16;
в) елемент № 19 чи елемент № 29.
11. Визначте основні хімічні властивості елементів, виходячи з електронної будови атома:
а) місце в періодичній системі;
б) ступінь металічності або неметалічності;
в) вищий позитивний і негативний ступені окиснення;
г) формула вищого оксиду у вищому ступені окиснення;
д) формула гідрату вищого оксиду і його характер;
е) можливі формули сполук елементу з хлором і воднем.
Розгляньте елементи з порядковими номерами: 19, 7, 25, 17, 29.
12. Наведіть графічні формули сполук: амоній нітрат, ортофосфатна кислота, калій гідроген сульфат калію, вкажіть тип зв’язку між окремими атомами в кожному з них.
13. Поясніть, чому кисень у сполуках тільки двовалентний, а його аналог за періодичною системою може проявляти і більш високий ступінь окиснення (який?).
14. Використовуючи поняття про донорно- акцепторний механізм, складіть схему утворення частинок BF—4; NH+4. Вкажіть донори і акцептори в електронних парах, що беруть участь в утворенні ковалентного зв’язку.
15. Яким геометричним формулам відповідають частинки з sp, sp2, sp3, sp3d, sp3d2 – гібридизацією орбіталей центрального атома. Наведіть приклади таких частинок, поясніть їх просторову будову.
16. Розташуйте речовини кожного набору в напрямку зростання полярності зв’язку:
а) BeF2, CF4, YiF, BF3;
б) AsH3, PH3, NH3, SbH3;
в) MoBr2, SiBr4, NaBr, AlBr3;
г) NaI, NaCl, NaBr, NaF;
д) H2O, CH4, HF, NH3.
17. Чому молекули СО2 і SO3 неполярні, а молекули H2O і SO2 мають дипольний момент, незважаючи на те, що зв’язки С = О і S = О, як і Н – О, полярні?
18. У рамках методу молекулярних орбіталей поясніть, чому існують (або не існують) частинки:
а)  ;
;
б) H2, 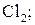
в) N2, 
19. Вкажіть які із зазначених частин є діамагнітні, а які – парамагнітні:
N2, H2, O2,  При відповіді користуйтесь методом молекулярних орбіталей.
При відповіді користуйтесь методом молекулярних орбіталей.
20. За яким типом зв’язку побудовані молекули:
N2, H2S, CO2, NH4Cl, MgBr2?
Зобразіть будову цих молекул у вигляді відповідних схем.
Дата добавления: 2015-10-31; просмотров: 108 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ДОСЛІД 1. Вимірювання електрорушійної сили гальванічного елемента | | | ВИЗНАЧЕННЯ ЗАГАЛЬНОЇ ТВЕРДОСТІ ВОДИ |