
Читайте также:
|
| Количество узлов в 1 мол. железе | Контрольная группа (n = 103) | Основная группа (n = 64) | Всего (n = 167) | |||
| абс. | % | абс. | % | абс. | % | |
| один | 83,5 | 85,4 | 84,2 | |||
| два | 11,6 | 10,6 | 11,2 | |||
| три | 4,9 | 4,0 | 4,6 | |||
| всего узлов: |
Таблица 2.6.
Размеры узлов
| Размеры узла (см) | Контрольная группа (n = 103) | Основная группа (n = 64) | Всего (n = 167) | |||
| абс. | % | абс. | % | абс. | % | |
| 1,0 – 2,0 | 16,5 | 14,7 | 15,8 | |||
| 2,0 – 3,0 | 33,9 | 32,0 | 33,2 | |||
| 3,0 – 4,0 | 28,1 | 21,3 | 25,5 | |||
| 4,0 – 5,0 | 12,4 | 26,7 | 17,9 | |||
| 5,0 – 6,0 | 6,6 | 4,0 | 5,6 | |||
| 6,0 – 8,0 | 2,5 | 1,3 | 2,0 | |||
| всего узлов: |
Наиболее часто распространение узлов в молочной железе было одиночным: 83,5% наблюдений в контрольной группе и 85,4% в основной группе (табл.2.5.).
Размеры узловых образований представлены в таблице 2.6. Размеры узлов до 2-х см выявлены в контрольной группе у 16,5%, в основной у 14,7% больных, от 2 до 5,0 см соответственно у 74,4% и 80,0%, а с более 5,0 см соответственно у 9,1% и 5,3% больных.
Таким образом, сравниваемые группы больных с узловыми доброкачественными заболеваниями молочной железы оказались сопоставимы по возрастному составу, срокам заболевания, локализации, распространённости и размерам патологического процесса. Можно отметить, что при преобладании удельного веса фиброаденом молочной железы над узловой мастопатией в основной группе по сравнению с контрольной, их общее количество в сумме пропорционально.
2.3. Методы исследования в клинике
2.3.1. Клинический осмотр.
При обследовании больных важное значение придавалось сбору анамнестических сведений, включающих жалобы, сроки заболевания, результаты проведённого ранее обследования и лечения. Большое внимание уделялось изучению медицинской документации, данных динамического наблюдения, выяснению наследственных факторов, перенесённых заболеваний.
Существенное значение имело углублённое изучение гинекологического анамнеза (начало, продолжительность и характер менструального цикла, течение беременностей и родов, прерывание беременностей, заболевания).
Оценивалось общее состояние больных, конституционные особенности, размеры грудной клетки, тургор кожи, выраженность подкожной жировой клетчатки.
При осмотре молочных желёз обращалось внимание на их объём и форму, а также симметрию. Изучалось расположение сосково – ареолярных комплексов, наличие рубцовых деформаций, состояние регионарных лимфоузлов. Осмотр и пальпация проводились в вертикальном и горизонтальном положении. При выявлении узловых образований проводилась оценка их размеров, консистенции, подвижности и локализации. Размеры узлов определялись пальпаторным способом с поправкой на окружающий слой кожи и клетчатки.
Во время операции определялась локализация и распространённость патологического образования, объём раневой полости.
В послеоперационном периоде проводили динамическое наблюдение с целью оценки общего состояния оперированных больных, характера и сроков заживления ран, а также ближайших и отдалённых результатов.
2.3.2. Гематологические, биохимические и иммунологические показатели крови.
Для лабораторной оценки результатов хирургического лечения больных проведены исследования гематологических, биохимических и иммунологических показателей крови в до- и послеоперационном периоде. Гематологические исследования включали подсчёт количества эритроцитов, лейкоцитов в счётной камере, определение содержания гемоглобина унифицированным гемоглобинцианидным методом, скорости оседания эритроцитов микрометодом Панченкова (55).
Для исследовали биохимических и иммунологических показателей бралась кровь из локтевой вены путём пункции. Из биохимических показателей определялись: общий белок биуретовым методом, глюкоза ортотолуидиновым методом, билирубин методом Ендрасика – Клеггорна – Грофа, мочевина диацетилмоноксимным методом (55).
Из иммунологических показателей определялись следующие: Т-лимфоциты и их популяции методом розеткообразования, иммуноглобулины A, M, G методом радиальной иммунодиффузии, циркулирующие иммунокомплексы (ЦИК) методом преципитации с 3,5% раствором полиэтиленгликоля, фагоцитоз нейтрофилов и макрофагов с латексом (119).
2.3.3. Цито -, гистологические методы
С целью изучения морфологических особенностей опухолевидных образований до операции всем больным проводилась пункционная биопсия толстой иглой типа Дюфо на 8-15 дни менструального цикла. Кроме того во время операции выполнялась экспресс – биопсия для цитологического исследования.
После операции проводилось гистологическое исследование макропрепаратов.
2.3.4. Маммография
При обследовании состояния молочных желёз перед пластической операцией маммографии отводится исключительно важное место. Главное значение этого метода заключается в возможности диагностики непальпируемых опухолей (124, 206).
Маммографическое исследование выполнено больным с диагностической целью на отечественном микрофокусном аппарате «Электроника» в боковой и прямой проекциях в первую фазу менструального цикла (3 – 10 дни после окончания менструации).
2.3.5. Эхография
Ультразвуковое исследование молочных желёз входило в комплекс дооперационного обследования, а также выполнено у 15 оперированных больных в сроки до 6 месяцев после маммопластики с целью изучения динамики структурных изменений в молочных железах.
Ультразвуковое исследование проведено на аппаратах SAL-38 AS и SSD-650 (Япония) с частотой датчика 7,5 Мгц.
При анализе эхограмм определялись локализация, размеры и количество узловых образований, их форма и контуры. Кроме того изучалась структура ткани оперированной железы в сравнении с симметричным участком здоровой железы. Оценивалась внутреняя структура, наличие или отсутствие капсулы вокруг трансплантируемого материала.
2.3.6. Реография
С целью изучения регионального кровообращения проведена реография молочных желёз у 25 больных в сроки от 1недели до 6 месяцев после операции.
Использован отечественный реограф 4 РГ-2М. Для усиления записи полезного сигнала применена автоматизированная диагностическая система «Кредо», разработанная сервисным центром ТОО «ДНК и К» (г.Тверь, 1993).
Выбран биполярный вариант реографического исследования, позволяющий изучить изменения импенданса двух симметричных областей. При этом каждый из двух электродов является и измерительным и зондирующим. Использовано два вида отведений: продольное и поперечное. Реомаммография проводилась в горизонтальном положении пациенток, натощак или не ранее чем через 2 часа после приёма пищи, при спокойном поверхностном дыхании.
Для расчётов амплитудно – временных параметров использовали объёмную реограмму и её первую первую производную – дифференцированную реограмму. При этом рассчитывались реографический индекс (РИ) и диастолический индекс (ДИ).
При реографических исследованиях большое значение придаётся следующим параметрам: изучению скорости кровотока в тканях, точности математической модели определения ударного пульсового объёма крови, способу калибровки сигнала, типу и размерам электродов (114). Признаками нарушения гемодинамики органа являются: снижение амплитуды кривой, сглаженность её деталей, появление аркообразных форм, удлинение анакротической фазы. Кроме того, существенное внимание уделяется уменьшению артефактов, возникающих из-за смещения элекродов при исследовании (178).
Для повышения чувствительности метода, достоверности результатов и достижения помехоустойчивости нами с помощью математических расчётов определены наиболее оптимальные размер и форма электродов для реомаммографии (удостоверение на рац. предложение № 2127 от 16.11.99г., выд. БГМУ).
Математическая модель для определения диаметра электродов.
Для определения диаметра электродов воспользовались следующими формулами:
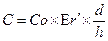 |
Где Со – ёмкость в вакууме,
ЕrI – относительная диэлектрическая проницаемость диэлектрика,
d - диаметр электродов,
h - расстояние между электродами (34).
С другой стороны:
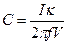 |
f – частота переменного тока,
V – действующее значение напряжения, прикладываемое к электродам (34).
 |
где Ie – ток проводимости,
tg d – коэффициент угла потерь (34).
Из технического описания реографа 4РГ-2М известно, что
f = 100 кГц; V=5в; Iе=1 мА.
Из справочных данных (В.А.Березовский, Н.И.Колотилов, 1990):
для жировой ткани -Er = 100 пф/см; Cо = 0,0695 пф, tg d =2,3.
Среднее значение h = 10 cм (11).
Вычисляем:
Iк = 1´10-3 / 2,3 = 43,47´10-5 А.
С = 43,47´10-5 / 2´3,14´105´5=1,38 пф.
 |
d=1,38´10 / 0,0695´100 = 1,98 см.
Таким образом, диаметр электродов (d) примерно равен 2,0 см.
На основании проведённых расчётов оптимальным мы считаем использование двух одинаковых электродов округлой формы и диаметром 20 мм.
2.3.7. Статистический метод.
Для статистической обработки результатов применяли общепринятые формулы (А.Ф.Серенко, В.В.Ермакова, 1984). При этом после составления вариационного ряда определялись показатели среднего арифметического значения (М), средняя арифметическая ошибка (м), среднее квадратическое отклонение (d), степень вероятности безошибочного прогноза (р) с учётом доверительного критерия (t) по таблице Стьюдента.
ГЛАВА 3. АНАЛИЗ РЕЗУЛЬТАТОВ
ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
Динамическое наблюдение за животными в послеоперационном периоде показало,что общее состояние их оставалось вполне удовлетворительным. Снижения веса не наблюдалось. Поведение животных и окраска шерсти не менялись. Заживление пострезекционных ран во всех случаях наступило первичным натяжением без признаков гнойно – воспалительных осложнений. Случаев отторжения трансплантата не отмечено. Нарушений объёма и формы молочных желёз также не отмечено. Средние сроки заживления ран составили 6,5 ± 0,2 суток.
[BIL1] Основные показатели иммунного статуса, выполненные в эксперименте, представлены в таблице 3.1.
Любое оперативное вмешательство сопровождается изменениями иммунной реактивности многофакторной природы. Одним из факторов индукции такой реакции в данном случае является характер трансплантата.
Реакция прослеживалась до 7 суток наблюдения и характеризовалась признаками слабо выраженного воспалительного процесса (повышение содержания лейкоцитов, снижение содержания комплемента, увеличение активности лейкоцитов в спонтанном НСТ-тесте и поглотительной активности), а также умеренной неспецифической активацией процессов иммуногенеза (увеличение титра гетероагглютининов). Однако достоверных изменений показателей иммунного статуса вплоть до 6 месяцев исследования не наблюдалось.
Таблица 3.1.
Иммунологические показатели в эксперименте
| Показатели | Сроки исследования | |||||
| Исходн. | 7 сут. | 14 сут. | 28 сут. | 90 сут. | 180 сут. | |
| Лейкоциты (х109 /л) | 5,2±1,6 | 6,8±0,8 | 4,8±2,1 | 4,9±0,9 | 4,9±1,2 | 4,8±1,8 |
| Псевдоэозино- филы (%) | 58,1 ±6,4 | 60,2 ±7,4 | 59,2 ±6,1 | 56,2 ±7,8 | 57,8 ±8,1 | 58,2 ±6,2 |
| Лимфоциты (%) | 42,6 ±5,8 | 38,2 ±5,6 | 39,4 ±4,8 | 42,2 ±6,2 | 41,1 ±4,2 | 40,2 ±4,2 |
| Т-лимфоциты (% от лимфоцитов) | 61,7 ±7,4 | 58,4 ±4,5 | 59,2 ±3,4 | 60,2 ±4,2 | 60,8 ±3,6 | 62,0 ±4,8 |
| Фагоцитоз (%) | 32,0 ±6,4 | 36,4 ±3,2 | 31,1 ±3,2 | 33,0 ±3,2 | 33,6 ±3,4 | 34,0 ±4,0 |
| НСТ-тест спонт. (%) | 8,2±1,1 | 11,2 ±2,2 | 6,4±1,8 | 6,8±1,4 | 6,9±1,2 | 8,0±1,3 |
| НСТ-тест индуц. (%) | 43,1 ±6,4 | 42,6 ±3,5 | 40,9 ±4,1 | 43,0 ±3,4 | 42,1 ±2,5 | 40,0 ±2,1 |
| Активность комплемента (ед.) | 27,2 ±1,4 | 24,0 ±1,2 | 25,4 ±1,2 | 27,1 ±0,9 | 27,2 ±0,8 | 25,5 ±0,5 |
| Титр гетеро- агглютининов | 4,2±1,2 | 4,8±1,4 | 4,5±0,8 | 4,8±2,0 | 4,3±1,5 | 4,0±1,0 |
При рассмотрении этих показателей можно выделить два типа динамических кривых (рис. 3.1. и 3.2.).
1 тип характеризуется недостоверным подъёмом исследуемых показателей на 7 сутки, с последующим падением на 14 сутки и плавным подъёмом к исходному уровню в сроки 3-6 месяцев после трансплантации. К этому типу можно отнести изменения показателей фагоцитарной активности, титра гетероагглютининов, содержания псевдоэозинофилов и общего ко- личества лейкоцитов, а также спонтанного НСТ-теста.
2 тип характеризуется недостоверным падением исследуемых показателей на 7 сутки и постепенным возвращением их к исходным уровням к 3 месяцу. К этому типу можно отнести динамику изменений показателей лимфоцитов, Т-лимфоцитов, НСТ- теста индуцированного и активности комплемента.
Таким образом, при пластике пострезекционных дефектов молочной железы биотрансплантатом «Аллоплант» у экспериментальных животных не зарегистрировано системных иммунных признаков выраженного воспаления и реакций отторжения трансплантата.
Рис.3.1.
Изменения фагоцитоза.
 |
Рис. 3.2.
Динамика содержания Т-лимфоцитов
 |
.
Морфологические аспекты маммопластики с применением трансплантата ««Аллоплант».
В ранние сроки после пластики пострезекционных дефектов молочных желёз наряду с изучением морфологической картины проводился подсчёт клеточного состава краевой и реактивной зон тканевого ложа в 1-8 полях зрения.
7 день эксперимента.
Трансплантат вплотную прилегает к стенкам раневой полости и плотно окружен тяжами незрелой соединительной ткани. Последняя содержит множество мелких сосудов выстланных высоким эндотелием. Новообразованные сосуды располагаются группами. Клеточный состав перифокальной зоны тканевого ложа многообразный, причём превалируют лимфо-гистиоцитарные элементы. По периферии трансплантата отмечается набухание коллагеновых волокон и миграция фибробластов из тканевого ложа (рис.3.3.). В краевой зоне тканевого ложа наблюдается прорастание эндотелиальных тяжей и кровеносных сосудов. В реактивной зоне эпителий молочных ходов неравномерной толщины, из однорядного местами переходит в многорядный. При этом базальный слой имеет кубическую форму и округлое ядро, а эпителий, смотрящий в просвет - вытянутое ядро.
Относительный клеточный состав в краевой зоне - в одном поле зрения:
фиброциты-10%, фибробласты-16%, лимфоциты-27%, плазматические-11%, моноциты-27%, макрофаги-9%.
Относительный клеточный состав реактивной зоны - в 4 полях зрения:
фиброциты-8%, фибробласты-15%, лимфоциты-20%, плазматические-12%, моноциты-30%,макрофаги-15%.
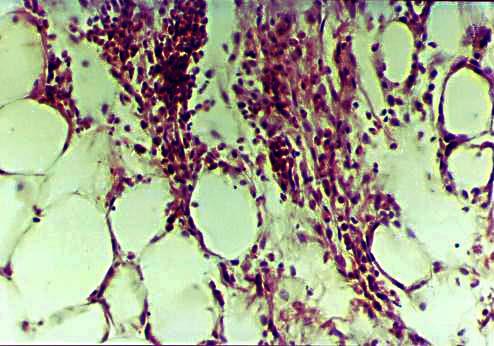 |
Рис.3.3. 7-е сутки после операции. Миграция клеточных элементов в трансплантат и формирование незрелой соединительной ткани. Окраска гематоксилином и эозином. х150.
14 день эксперимента.
Наблюдается деградация трансплантата особенно его стромы. По периферии трансплантата возрастает относительное количество фибробластов, макрофагов и плазматических клеток (рис.3.4.). Грануляционная ткань мелкими фрагментами огибает жировые дольки. В краевой зоне тканевого ложа на фоне разряжения клеточных элементов наблюдается рост числа фибробластов веретенообразной формы. Регистрируются единичные митозы. Во вновь образованных сосудах стенки становятся двухрядными, эндотелий их набухший. Группы сосудов по 3-4. В реактивной зоне продолжается дифференцировка кровеносных сосудов и начинается формирование микроциркуляторного русла.
Относительный клеточный состав краевой зоны - в 3 полях зрения:
фиброциты-27%, фибробласты-26%, лимфоциты-15%, плазматические-4%, моноциты-13%, макрофаги-15%.
Относительный клеточный состав реактивной зоны - в 8 полях зрения:
фиброциты-33%, фибробласты-20%, лимфоциты-19%, плазматические-9%, моноциты-7%, макрофаги-12%.
 |
Рис.3.4. 14-е сутки после операции. Выраженная макрофагально-фибробластическая реакция на структурные компоненты трансплантата. Лизис трансплантата. Окраска гематоксилином и эозином х75.
21 день эксперимента.
Наблюдается дальнейшая деструкция трансплантата с разрушением жировых долек. Границы трансплантата становятся расплывчатыми. Прорастающая соединительная ткань приобретает черты оформленной, в клеточном составе преобладают моноциты, фибробласты и фиброциты. На фоне продолжающегося ангиогенеза воспалительная инфильтрация менее значимая и представлена макрофагами и фибробластами. Отмечается прорастание расширенных молочных ходов в формирующийся регенерат. Стенки молочных ходов выстланы двухрядным кубическим эпителием. Группы сосудов по 2-3 обычного капиллярного строения (рис.3.5.).
Относительный клеточный состав краевой зоны - в 4 полях зрения: фиброциты-12%, фибробласты-20%, лимфоциты-23%, плазматические-6%, моноциты-25%, макрофаги-14%.
Относительный клеточный состав реактивной зоны - в 8 полях зрения:
фиброциты-20%, фибробласты-28%, лимфоциты-30%, плазматические-3%, моноциты-10%, макрофаги-9%.
 |
Рис.3.5. 21-е сутки после операции. Инфильтрация трансплантата моноцитами и фибробластами, формируются новообразованные сосуды в краевой зоне. Окраска азуром и эозином по Лилли. х150.
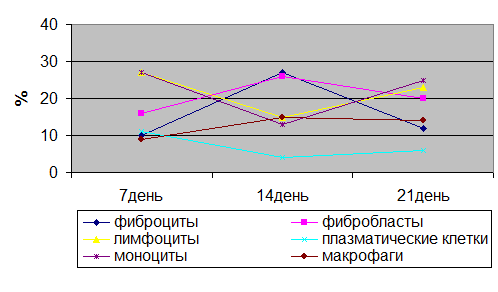 |
Относительный клеточный состав в краевой зоне
Рис.3.7.
 |
Из представленных графических рисунков (3.6 и 3.7.) видно, что в краевой и реактивной гистотопографических зонах на ранних сроках трансплантации процесс регенерации имеет особенности, которые выражаются в различном удельном весе клеточных популяций инфильтрата. В краевой зоне большее значение имеет клеточная кооперация фибробластов, лимфоцитов и моноцитов. В реактивной зоне основную функцию несут фибробласты, фиброциты и лимфоциты. Кроме этого в краевой зоне более выражена макрофагальная реакция. Плазматические клетки в обеих зонах в период от 7 до 21 суток имеют тенденцию к снижению.
28 день эксперимента.
Доминируют процессы замещения трансплантата, реактивные изменения в тканевом ложе нивелируются. Продолжается деградация трансплантата и фагоцитоз распадающихся элементов. Грануляционная ткань определяется в виде фрагментов. Воспалительная инфильтрация представлена исключительно мононуклеарными клетками (моноциты, лимфоциты, макрофаги, фибробласты). В оформленной соединительной ткани преобладают клетки веретёноклеточного вида (фиброциты) (рис.3.8). Молочные ходы имеют суженный вид, эпителий выстилающий их стенки многорядный. Сосуды образуют петлистые сети, которые распределены равномерно в структуре стромы и вокруг молочных ходов.
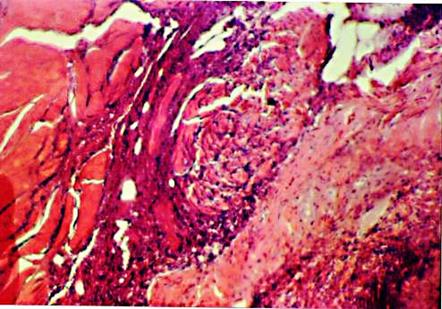 |
Рис.3.8. 28-е сутки после операции. Продолжается процесс замещения трансплантата. Окраска гематоксилином и эозином. х75.
2 месяц эксперимента.
Границы трансплантата определить практически невозможно. Строма, в основном, представлена оформленной соединительной тканью. Преобладающее количество составляют фиброциты и фибробласты, незначительное число плазматических клеток и макрофагов. Остатки деградированного трансплантата определяются в виде чешуек (рис.3.9.). Наряду с оформленной соединительной тканью начинает формироваться собственная жировая ткань. По периферии трансплантата прослеживается паренхима молочной железы. Эластическая строма при замещении коллагеновых пучков теряет каркасные свойства и приводит к коллатеральной регенерации, когда новообразованная ткань огибает структуры эластических волокон.
 |
Рис.3.9. 2-месяца после операции. В трансплантате еще сохранены жировые дольки, вокруг которых располагаются соединительнотканные структуры со слабой мононуклеарной инфильтрацией. Окраска гематоксилином и эозином. х150.
3 месяц эксперимента.
Трансплантат практически лизировался, остатки его представлены в виде бесформенных масс, вокруг которых наблюдается незначительная инфильтрация. Отмечается образование оформленной соединительной ткани, имеющей трехмерный волокнистый каркас с локальными бесформенными включениями сохранившихся эластических волокон трансплантата. Регенерирующие элементы паренхимы молочной железы представлены узкими протоками фестончатого типа и формирующимися альвеолами и занимают значительную площадь исследуемого материала. Строма представлена рыхлой соединительной тканью с прослойками жировой ткани (рис.3.10).
 |
Рис.3.10. 3 месяца после операции. Новообразованные молочные ходы в окружении созревающей соединительной ткани. Окраска гематоксилином и эозином. х150.
6 месяц эксперимента.
Полное замещение трансплантата паренхимой и стромой, идентичной по структуре окружающей её ткани молочной железы. Остатков трансплантата не зарегистрировано. В единичных случаях в междольковой строме молочной железы отмечена лимфоидная инфильтрация и полнокровие капилляров, что возможно связано с циклическими гормональными изменениями (П.А. Чумаченко, Е.С. Панкратова, 1997).
 |
Рис.3.11. 6 месяцев после операции. Трансплантат замещен железистым аппаратом и зрелой оформленной соединительной тканью. Окраска гематоксилином и эозином. х75.
Таким образом, фиброструктура исследуемого биоматериала имеет минимальный межфибриллярный объем, в который не может инфильтрироваться дополнительная клеточная масса без элиминации компонентов матрикса. Отсюда невозможность быстрой инфильтрации трансплантата - пик наблюдается на 14-е сутки.
Пролонгированная макрофагальная инфильтрация приводит к элиминации межуточного вещества соединительнотканного трансплантата с последующим постепенным формированием по ходу сохранившихся его волокнистых структур новообразованных коллагеновых волокон. В опытной серии следующая динамика репаративных процессов: незначительные сосудистые изменения в тканевом ложе > умеренный лимфо-гистиоцитарный инфильтрат > выраженная макрофагальная стадия > медленное формирование структурно адекватного регенерата. Итог репаративного процесса - образование ткани молочной железы состоящей из зрелой оформленной соединительной ткани с разнонаправленной ориентацией пучков и собственно железистой ткани.
[BIL1]
Дата добавления: 2015-09-05; просмотров: 126 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Распределение больных по срокам заболевания | | | Мастопатия, миома |