
Читайте также:
|

Ароматические галогенопроизводные с галогеном в ядре (галогенарилы) – довольно инертные вещества по сравнению с галогенопроизводными алифатического ряда. Поэтому они с большим трудом вступают в реакции нуклеофильного замещения. Такая пассивность атома галогена в галогенарилах объясняется частичной двоесвязанностью его с бензольным кольцом:

Это напоминает поведение галогенопроизводных непредельных углеводородов, у которых атом галогена находится при углероде, связанном двойной связью. Поэтому для проведения реакций галогенарилов с нуклеофильными реагентами необходимы жесткие условия (высокая температура и давление):
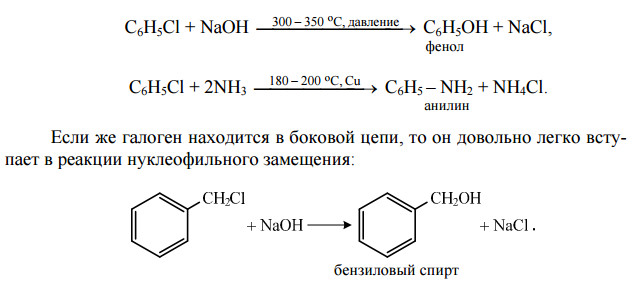
Атомы галогенов довольно подвижны и могут замещаться под действием разнообразных нуклеофилов, что используется для синтеза разнообразных производных:
Реакции элиминирования (отщепления) – дегидрогалогенирования
В результате реакций элиминирования в случае алкилгалогенидов образуется алкены и галогеноводороды.
Например, при нагревании этилхлорида с щёлочью в спирте происходит элиминирование HCl и идёт образование этилена:
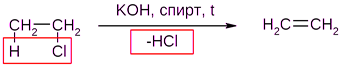
Следует обратить внимание на то, что если проводить эту реакцию в воде, а не в спирте, то основным продуктом будет спирт, а не алкен.
В случае несимметричных алкилгалогенидов реакции дегидрогалогенирования идут в соответствии с правилом Зайцева: Отщепление атома водорода в реакциях отщепления HX происходит от наименее гидрогенизированного атома углерода.
7. Ароматические соединения (арены). Ароматический характер бензола. Энергия сопряжения, критерии ароматичности. Реакции электрофильного замещения бензола. Строение π- и σ-комплексов. Влияние заместителей в бензольном кольце на направление и скорость реакций электрофильного замещения.
Главной особенностью ароматических углеводородов является равномерное распределение π-электронной плотности в молекуле. Единая устойчивая замкнутая система π-электронов в циклической молекуле – основной признак ароматичности. Необходимым условием для такой делокализации π-электронов является строгая параллельность осей 2р-орбиталей, участвующих в образовании замкнутой π-электронной системы. Поэтому молекулы ароматических соединений обязательно имеют плоское строение. Если же это условие не выполняется, то круговое сопряжение π-электронов нарушается. В результате это соединение не является ароматическим. Для ароматических соединений характерно также определенное число π-электронов в молекуле. Немецкий химик-теоретик Э.Хюккель вывел п р а в и л о (1931): плоские циклические соединения, имеющие сопряженную систему π-электронов, могут быть ароматическими, если число этих электронов равно 4n + 2 (где п = 0, 1, 2, 3 и т.д.). Другими словами, в ароматических соединениях может содержаться 2, 6, 10, 14 π-электронов и т.д. Это правило строго выполняется только для моноциклических соединений.
Молекулы, которые обладают совокупностью характерных структурных, энергетических и химических свойств, обусловленных наличием плоской циклической структуры с системой сопряженных связей, образованной делокализованными p-электронами, называются ароматическими соединениями.
Единой характеристики, позволяющей надежно классифицировать соединение как ароматическое или неароматическое не существует. Основными характеристиками ароматических соединений являются:
· склонность к реакциям замещения, а не присоединения (определяется легче всего, исторически первый признак, пример — бензол, в отличие от этилена не обесцвечивает бромную воду)
· выигрыш по энергии, в сравнении с системой несопряженных двойных связей. Также называется Энергией Резонанса (усовершенствованный метод — Энергией Резонанса Дьюара) (выигрыш настолько велик, что молекула претерпевает значительные преобразования для достижения ароматичного состояния, например циклогексадиен легко дегидрируется до бензола, двух и трехатомные фенолы существуют преимущественно в форме фенолов (енолов), а не кетонов и.т.д.).
· наличие кольцевого магнитного тока;
· наличие самой плоскости (минимально искаженной), в которой лежат все (либо не все — гомоароматичность) атомы образующие ароматическую систему. При этом кольца пи-электронов, образующиеся при сопряжении двойных связей (либо электронов входящих в кольцо гетероатомов) лежат над и под плоскостью ароматической системы.
· практически всегда соблюдается Правило Хюккеля: ароматичной может быть лишь система, содержащая (в кольце) 4n+2 электронов (где n = 0, 1, 2, …). Система, содержащая 4n электронов является антиароматичной (в упрощенном понимании это обозначает избыток энергии в молекуле, неравенство длин связей, низкая стабильность — склонность к реакциям присоединения).
Дата добавления: 2015-08-27; просмотров: 176 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Галогенпроизводные углеводородов. Реакции нуклеофильного замещения и отщепления. Ароматические галогенпроизводные. | | | Реакции электрофильного замещения бензола. |