
Читайте также:
|
Дикарбоновые кислоты взаимодействуют с диаминами и диолами с образованием соответственно полиамидов и полиэфиров, которые используются в производстве синтетических волокон.

4. Алкены. Реакции электрофильного присоединения алкенов (реакции Аde): Правило Марковникова и его объяснение. Свободнорадикальное присоединение галогенов и бромоводорода. Аллильное галогенирование. Гомогенное и гетерогенное гидрирование.
Алкены (олефины). Углеводороды, содержащие одну двойную углерод-углеродную связь, в открытой цепи называются алкенами. Общая и брутто формула СnН2n. Ряд, члены которого отличаются на (2Н)n называется изологическим рядом. Первый представитель СН2=СН2 (этен - этилен), sp2- гибридизация.
AdE реакции – основной тип превращений алкенов. По электрофильному механизму к алкенам могут присоединяться галогены, галогеноводороды, серная кислота, вода и другие электрофильные реагенты.
Общий механизм реакции включает ряд последовательных стадий:
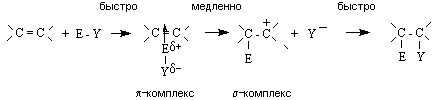
На первой стадии электрофил образует p -комплекс с алкеном, в котором двойная связь выступает как донор, а электрофил как акцептор электронов. Далее p -комплекс медленно перегруппировывается в карбокатион (s -комплекс). На последней стадии происходит быстрое взаимодействие карбокатиона с нуклеофилом (Y -) с образованием продукта присоединения.
Алкены реагируют с бромом и хлором с образованием продуктов присоединения по двойной связи одной молекулы галогена с выходом близким к количественному. Фтор слишком активен и вызывает деструкцию алкенов. Присоединение йода к алкенам в большинстве случаев представляет собой обратимую реакцию, равновесие которой смещено в сторону исходных реагентов.
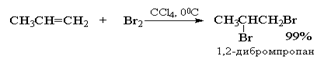

Присоединение галогеноводородов (гидрогалогенирование)
Другой важной реакций электрофильного присоединения к алкенам является давно известное гидрогалогенирование алкенов.
Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей. Электрофилом является протон Н+ в составе молекулы галогеноводорода HX (X - галоген).
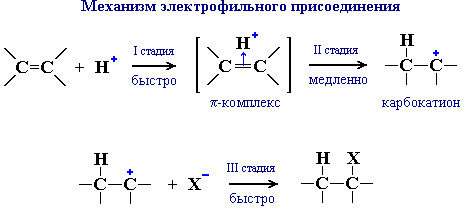
Направление реакции присоединения галогеноводородов к алкенам несимметричного строения (например, к пропилену CH2=CH–СН3) определяется правилом Марковникова:
В реакциях присоединения полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т.е. атому углерода, связанному с наибольшим числом атомов водорода).
Присоединение против правила Марковникова отмечается в случаях, когда заместитель при двойной связи оттягивает электронную плотность на себя, т.е. проявляет электроноакцепторные свойства (– I и/или – М -эффект).
Например, в реакции трихлорпропена Сl3C-CH=CH2 с HХ водород присоединяется к менее гидрогенизированному атому углерода, а Х – к более гидрогенизированному. Это обусловлено тем, что группа СCl3 проявляет отрицательный индуктивный эффект и p-электронная плотность связи С=С смещена к менее гидрогенизированному атому углерода.
Кроме того, если реакция присоединения идет не по электрофильному, а по радикальному механизму, то правило Марковникова также не соблюдается. Так, реакция HBr с пропиленом в присутствии пероксидов (H2O2 или R2O2), образующих свободно-радикальные частицы (НО· или RО·), происходит по радикальному механизму и идет против правила Марковникова.
Дата добавления: 2015-08-27; просмотров: 78 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Углеводы. Классификация и номенклатура. Строение, конфигурация и конформация. | | | Аллильное замещение галогенами. |