
Читайте также:
|
Понятие термодинамической системы, классификация термодинамических систем.
Термодинамическая система — это некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом. Так же обычно полагается, что такая система подчиняется статистическим закономерностям. Для термодинамических систем справедливы законы термодинамики.
Термодинамические системы подразделяются на однородные по составу (например, газ в сосуде) и неоднородные (вода и пар или смесь газов в сосуде).
Выделяют также изолированные системы, то есть системы, которые не обмениваются с окружающей средой ни энергией, ни веществом, и закрытые системы, которые обмениваются со средой только энергией, но не обмениваются веществом. Если же в системе происходят обменные процессы с окружающей средой, то её называют открытой.
Параметры для описания состояния термодинамической системы процессов, их классификация.
Состояние системы определяется ее физическими и химическими свойствами (объем, давление, температура, химический состав, внутренняя энергия, энтальпия, энтропия и др.), которые подразделяются на параметры состояния и функции состояния.
Параметры состояния – свойства системы, выбранные в качестве независимых переменных. Функция состояния – величина, определяемая этими параметрами, однозначно характеризует систему и не зависит от пути ее перехода из одного состояния в другое. (если для 1 моля идеального газа параметрами состояния выбрать давление и температуру, то функцию состояния объем можно рассчитать по уравнению состояния Менделеева-Клапейрона РV=RТ).
Для описания термодинамической системы вводят так называемые термодинамические величины — набор физических величин, значения которых определяют термодинамическое состояние системы. Примерами термодинамических величин являются:
· температура
· давление
· объем
· внутренняя энергия
· энтропия
· энтальпия
· свободная энергия Гельмгольца
· энергия Гиббса
Если термодинамическое состояние системы не меняется со временем, то говорят, что система находится в состоянии равновесия. Строго говоря, термодинамические величины, приведённые выше, могут быть определены только в состоянии термодинамического равновесия.
ü Классическая(техническая термодин,химическая термодин)
ü Неравновесная
ü Термодинамика Пригожина
Температу́ра (от лат. temperatura — надлежащее смешение, нормальное состояние) — скалярная физическая величина, характеризующая приходящуюся на одну степень свободы среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия.
Давле́ние (P) — физическая величина, характеризующая состояние сплошной среды и численно равная силе 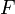 , действующей на единицу площади поверхности
, действующей на единицу площади поверхности 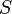 перпендикулярно этой поверхности. В простейшем случае изотропной равновесной неподвижной среды давление не зависит от ориентации поверхности. В данной точке давление определяется как отношение нормальной составляющей силы Fn, действующей на малый элемент поверхности, к его площади:
перпендикулярно этой поверхности. В простейшем случае изотропной равновесной неподвижной среды давление не зависит от ориентации поверхности. В данной точке давление определяется как отношение нормальной составляющей силы Fn, действующей на малый элемент поверхности, к его площади:
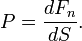
Объём — количественная характеристика пространства, занимаемого телом или веществом. Объём тела или вместимость сосуда определяется его формой и линейными размерами.
Вну́тренняя эне́ргия тела (обозначается как E или U) — полная энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле сил. Следовательно, внутренняя энергия складывается из кинетической энергии хаотического движения молекул, потенциальной энергии взаимодействия между ними и внутримолекулярной энергии.
энтропии мера необратимого рассеивания энергии, мера отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
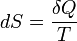 ,
,
где dS — приращение энтропии; δQ — минимальная теплота подведенная к системе; T — абсолютная температура процесса;
Энтальпи́я тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот = pSx = pV
H = E = U + pV
энтальпия представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии
в процессе изменения состояния
ΔH = H2 − H1
Изменение энтальпии не зависит от пути процесса, определяясь только начальным и конечным состоянием системы.
Свобо́дная эне́ргия Гельмго́льца (или просто свобо́дная эне́ргия) — термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами.
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это термодинамический потенциал следующего вида:
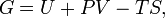
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Дата добавления: 2015-08-20; просмотров: 234 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Голубая "Фиалка" ПНК Кирова и белая "Летняя" Троицкая. | | | Согласно закону Гей-Люссака, при изобарном процессе в идеальном газе . |