
Читайте также:
|
Изотермический процесс — термодинамический процесс, происходящий в физической системе при постоянной температуре. Для осуществления изотермического процесса систему обычно помещают в термостат (массивное тело, находящееся в тепловом равновесии), теплопроводность которого велика, так что теплообмен с системой происходит достаточно быстро по сравнению со скоростью протекания процесса и температура системы в любой момент практически не отличается от температуры термостата.
Адиабатный процесс – это процесс, при котором рабочее тело не обменивается теплотой с окружающей средой.
Политропным процессом называется любой произвольный процесс изменения состояния рабочего тела, происходящий при постоянной теплоёмкости.
4. Понятие внутренней энергии, теплоты и работы.
Вну́тренняя эне́ргия тела (обозначается как E или U) — полная энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле сил. Следовательно, внутренняя энергия складывается из кинетической энергии хаотического движения молекул, потенциальной энергии взаимодействия между ними и внутримолекулярной энергии.
Изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Теплота — энергетическая характеристика процесса теплообмена, определяется количеством энергии, которое получает или отдает тело при теплообмене. Теплота измеряется в тех же единицах, что работа и энергия.
Теплота — внутренняя энергия, которая самопроизвольно (без внешнего воздействия) переходит от тел более нагретых к телам менее нагретым путем теплопроводности или лучеиспускания.
работа, совершенная газом (работа совершенная над газом), рассчитывается как интеграл давления по объёму:
 . Величина работы зависит от пути, по которому термодинамическая система переходит из состояния 1 в состояние 2, и не является функцией состояния системы.
. Величина работы зависит от пути, по которому термодинамическая система переходит из состояния 1 в состояние 2, и не является функцией состояния системы.
5. Формулировка первого закона термодинамики, его практическое использование.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем. Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника.
dU = δQ − δA + μdN + δA'.
Практическое применение: решение задач:
а) качественных
б) количественных
6. Виды энергии, их способность преобразования в другие формы и работу, классификация.
Энергия - это мера возможности совершить работу.
Виды:
1. Тепловая энергия (горячая пища, тепло систем отопления в современной квартире, или тепло печки в деревенском доме)
2. Электрическая энергия
3. Механическая энергия (потенциальная+кинетическая)
Первым, используемым человеком, преобразователем энергии можно считать парус - использование энергии ветра для перемещения по воде, дальнейшие развитее, это использование ветра и воды в ветряных и водяных мельницах. Паровые машины на фабриках и заводах резко увеличили производительность труда. Паровозы и теплоходы сделали перевозки по суше и морю более быстрыми и дешевыми. Широкое внедрение электрических машин, двигателей превращающих электрическую энергию в механическую и генераторов для производства электроэнергии из механической энергии, ознаменовало собой новый скачёк в развитии техники. Появилась возможность передавать энергию на большие расстояния в виде электроэнергии, родилась целая отрасль промышленности энергетика.
7. Формулировка С.Карно 2-го закона термодинамики, его роль и практическое применение.
В 1824 г. С.Карно впервые рассмотрел обратимый термодинамический цикл, состоящий из двух изотерм и двух адиабат. Этот цикл представляет собой замкнутый процесс, совершаемый рабочим телом в идеальной тепловой машине при наличии двух истопников теплоты: нагревателя (горячего источника) с температурой T1 и холодильника (холодного источника) с температурой T2 Цикл Карно вpv-диаграмме
 Процессы 1—2 и 3—4 являются изотермическими, а 2—3 и 4—1 — адиабатными. Начальная температура рабочего тела в цикле принимается равной температуре нагревателя T1. При изотермическом расширении от состояния 1 до состояния 2 рабочее тело получает от нагревателя количество теплоты q1 при температуре T1. На участке 2—3 рабочее тело адиабатно расширяется. При этом температура рабочего тела понижается от T1 до T2, а давление падает от p2 доp3. При сжатии по изотерме 3—4 от рабочего тела отводится к холодильнику количество теплоты q2 при температуре T2. Дальнейшее сжатие по адиабате 4—1 приводит к повышению температуры рабочего тела от T2 до T1, а рабочее тело возвращается в первоначальное состояние.
Процессы 1—2 и 3—4 являются изотермическими, а 2—3 и 4—1 — адиабатными. Начальная температура рабочего тела в цикле принимается равной температуре нагревателя T1. При изотермическом расширении от состояния 1 до состояния 2 рабочее тело получает от нагревателя количество теплоты q1 при температуре T1. На участке 2—3 рабочее тело адиабатно расширяется. При этом температура рабочего тела понижается от T1 до T2, а давление падает от p2 доp3. При сжатии по изотерме 3—4 от рабочего тела отводится к холодильнику количество теплоты q2 при температуре T2. Дальнейшее сжатие по адиабате 4—1 приводит к повышению температуры рабочего тела от T2 до T1, а рабочее тело возвращается в первоначальное состояние.
Суммарная работа цикла lц графически изображается площадью 12341.
8. Понятие энтропии. Формулировка 2-го закона термодинамики с использованием понятия энтропия.
Энтропи́я - мера беспорядка системы, состоящей из многихэлементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта который может иметь разные исходы, а значит и количествоинформации.
Энтропия -- это функция состояния, то есть любому состоянию можно сопоставить вполне определенное значение энтропии.
Формулировка закона: «Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано. В состоянии с максимальной энтропией макроскопические необратимые процессы невозможны.
9. Понятие энтальпии, свободной энтальпии и свободной энергии.
Энтальпи́я - термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Изменение энтальпии не зависит от пути процесса, определяясь только начальным и конечным состоянием системы. Если система каким-либо путём возвращается в исходное состояние (круговой процесс), то изменение любого её параметра, являющегося функцией состояния, равно нулю, отсюда ΔH = 0.
Свободная энтальпия - один из потенциалов термодинамических системы. Обозначается G, определяется разностью между энтальпией H и произведением энтропии S на термодинамическую температуру Т:
ΔтG = ΔтH - T·ΔтS.
Классическим определением свободной энтальпии является выражение:
G=U+PV-TS,
где U - внутренняя энергия, P - давление, V - объем, T - абсолютная температура, S - энтропия.
Свобо́дная эне́ргия - термодинамический потенциал, убыль которого в квазистатическомизотермическом процессе равна работе, совершённой системой над внешними телами.
10. Понятие эксергии и анергии, представление различных форм энергии на их основе.
Эксергия - часть энергии, равная максимальной полезной работе работа, которую может совершить термодинамическая система при переходе из данного состояния в состояние равновесия с окружающей средой. Эксергией иногда называетсяработоспособность системы. Использование понятия эксергии даёт возможность количественно определить влияние неравновесия термодинамических процессов наэффективность преобразования энергии, то есть позволяет вычислять особенности второго начала термодинамики: выделить ту часть энергии, которая не может быть использована из-за газодинамических явлений, трения, теплообмена. Такой подход даёт возможность анализировать степень термодинамической доскональности того или другого элемента установки и не требует предварительной оценки работоспособности всей установки в целом.
Анергия – это неработоспособная (технически непригодная, непревратимая) часть полной энергии системы.
11. Формулировка тепловой теоремы Нернста, её практическое значение и использование.
Это физический принцип, определяющий поведение энтропии при приближениитемпературы к абсолютному нулю. Является одним из постулатов термодинамики, принимаемым на основе обобщения значительного количества экспериментальных данных.
Третье начало термодинамики может быть сформулировано так:
«Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система».
Третье начало термодинамики относится только к равновесным состояниям.
Третье начало термодинамики позволяет находить абсолютное значение энтропии, что нельзя сделать в рамках классической термодинамики (на основе первого и второго начал термодинамики). В классической термодинамике энтропия может быть определена лишь с точностью до произвольной аддитивной постоянной S0, что не мешает термодинамическим исследованиям, так как реально измеряется разность энтропий (S0) в различных состояниях. Согласно третьему началу термодинамики, при  значение
значение  .
.
Значение принципа Нернста состоит в том, что зависимость энтропии реакции от температуры может быть выведена, согласно термодинамической теории, исключительно из данных по теплоемкости для отдельных участвующих в реакции веществ. Это значит, что, если известно значение S при какой-либо одной температуре (при T = 0 S = 0), значения энтропии реакции при других температурах вычисляются исключительно из тепловых измерений. Аналогично этому, величина H может быть получена из калориметрических данных путем непосредственного измерения теплоты данной реакции либо косвенно, путем измерения теплот других реакций и применения закона Гесса. Следовательно, подстановка полученных значений H и S в уравнение (9) или (11) дает гиббсову энергию или константу химического равновесия исключительно из тепловых измерений. Это позволяет предвидеть направление и равновесное состояние химической реакции еще до того, как найден способ ее проведения.
Для практического применения третьего начала термодинамики требуются точные результаты измерений теплоемкости вплоть до самых низких доступных температур, желательно до температуры жидкого гелия (около 4 К).
12. Понятие идеального газа. Уравнение состояния идеального газа.
ИДЕА́ЛЬНЫЙ ГАЗ - теоретическая модель газа, в которой пренебрегают размерами частиц газа, не учитывают силы взаимодействия между частицами газа, предполагая, что средняя кинетическая энергия частиц много больше энергии их взаимодействия, и считают, что столкновения частиц газа между собой и со стенками сосуда абсолютно упругие.
Идеальным принято считать газ, если: а) между молекулами отсутствуют силы притяжения, т. е. молекулы ведут себя как абсолютно упругие тела;
б) газ очень разряжен, т.е. расстояние между молекулами намного больше размеров самих молекул;
в) тепловое равновесие по всему объему достигается мгновенно. Условия, необходимые для того, чтобы реальный газ обрел свойства идеального, осуществляются при соответствующем разряжении реального газа. Некоторые газы даже при комнатной температуре и атмосферном давлении слабо отличаются от идеальных. Основными параметрами идеального газа являются давление, объем и температура.
Уравнение состояния идеального газа — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
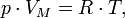 где
где
§  — давление,
— давление,
§ 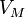 — молярный объём,
— молярный объём,
§  — универсальная газовая постоянная
— универсальная газовая постоянная
§  — абсолютная температура,К
— абсолютная температура,К
13. Элементарные термодинамические процессы, их описание и изображение в различных координатах.
ИЗОХОРНЫЙ:
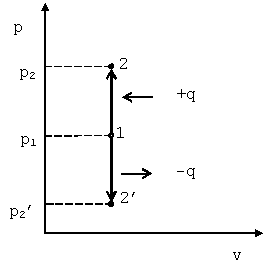 Изохорный процесс может протекать с повышением давления (процесс 1-2) и с понижением (процесс 1-2’). Такой процесс может совершаться рабочим телом, находящимся в цилиндре при неподвижном поршне, если к рабочему телу подводится теплота от источника теплоты (см. рис. 4.1) или отводится теплота от рабочего тела к холодильнику. При изохорном процессе выполняется условиеdv=0 или v=const. Уравнение изохорного процесса получим из уравнения состояния идеального газа (см. &1.6) при v=const. В pv-координатах график процесса представляет собой прямую линию, параллельную оси p.
Изохорный процесс может протекать с повышением давления (процесс 1-2) и с понижением (процесс 1-2’). Такой процесс может совершаться рабочим телом, находящимся в цилиндре при неподвижном поршне, если к рабочему телу подводится теплота от источника теплоты (см. рис. 4.1) или отводится теплота от рабочего тела к холодильнику. При изохорном процессе выполняется условиеdv=0 или v=const. Уравнение изохорного процесса получим из уравнения состояния идеального газа (см. &1.6) при v=const. В pv-координатах график процесса представляет собой прямую линию, параллельную оси p.
Изобарный процесс (p=const)
В p-v координатах график процесса представляет собой прямую линию параллельную оси v (рис. 4.2). Изобарный процесс может протекать с увеличением объёма (процесс 1-2) и с уменьшением (процесс 1-2’). Запишем для точек 1 и 2 уравнения состояния: p·v1=R·T1; p·v2=R·T2.

|
| Рис. 4.2. График изобарного процессав p-v координатах |
Следовательно, для изобарного процесса

| (4.10) |
Приращение внутренней энергии газа  Работа газа
Работа газа  Так как p·v2=R·T2, а p·v1=R·T1, то l=R·(T2-T1). Следовательно, газовая постоянная имеет определённый физический смысл: это работа 1 кг газа в изобарном процессе при изменении температуры на один градус. Из выражения (4.3) следует, что в изобарном процессе q=cp·(T2-T1). В соответствии с первым законом термодинамики для изобарного процесса можно записать dq=du+p·dv= du+d(p·v)=di. Поэтому в изобарном процессе di=q=cp·(T2-T1). Из соотношений, характеризующих изобарный процесс, вытекает известное уравнение Майера. Так какdq=cp·dT=cv·dT+dl=cv·dT+R·dT, то R=cp-cv.
Так как p·v2=R·T2, а p·v1=R·T1, то l=R·(T2-T1). Следовательно, газовая постоянная имеет определённый физический смысл: это работа 1 кг газа в изобарном процессе при изменении температуры на один градус. Из выражения (4.3) следует, что в изобарном процессе q=cp·(T2-T1). В соответствии с первым законом термодинамики для изобарного процесса можно записать dq=du+p·dv= du+d(p·v)=di. Поэтому в изобарном процессе di=q=cp·(T2-T1). Из соотношений, характеризующих изобарный процесс, вытекает известное уравнение Майера. Так какdq=cp·dT=cv·dT+dl=cv·dT+R·dT, то R=cp-cv.
Используя выражение (4.5), можно показать, что в изобарном процессе энтропия газа

|
Изотермический процесс (T=const)
В p-v координатах график процесса изображается равнобокой гиперболой (рис. 4.3). Изотермический процесс может протекать как с увеличением объёма (процесс 1-2), так и с уменьшением объёма (процесс 1-2’).

|
| Рис. 4.3. График изотермического процесса вp-v координатах |
Запишем для точек 1 и 2 уравнения состояния p1·v1=R·T; p2·v2=R·T. Следовательно, для изотермического процессаp1·v1=p2·v2=const.
Приращение внутренней энергии газа

|
Работа газа
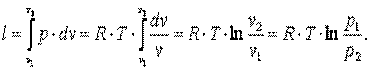
| (4.12) |
Теплота, подводимая в процессе
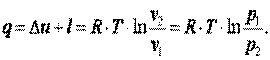
| (4.13) |
Изменение энтальпии газа Δi=Δu+Δ(p·v)=0.
Изменение энтропии газа

|
Адиабатный процесс
Адиабатный процесс – это процесс, при котором рабочее тело не обменивается теплотой с окружающей средой (dq=0). Для получения графика процесса в p-vкоординатах выполним некоторые преобразования.
В p-v координатах адиабатный процесс изображается неравнобокой гиперболой vk·p=const(рис. 4.4). Так как k>1, то адиабата проходит круче гиперболы. Адиабатный процесс может протекать как с увеличением объёма (процесс 1-2), так и с уменьшением объёма (процесс 1-2’).
14. Термодинамические циклы, их построение и практическое использование.
Термодинамический цикл - термодинамический процесс, в результате которого термодинамическая система после ряда изменений своего состояния возвращается в первоначальное состояние.

Цикл термодинамический, круговой процесс, осуществляемый термодинамической системой. Изучаемые в термодинамике циклы представляют собой сочетание различных термодинамических процессов, и в первую очередь изотермических, адиабатических, изобарических, изохорических. К Ц. т., исследование которых сыграло важную роль в разработке общих основ термодинамики и в развитии её технических приложений, относятся: Карно цикл (рис., а), цикл Клапейрона (рис., б), цикл Клаузиуса — Ранкина (рис., в, см. Ранкина цикл) и ряд др. На основе подобных Ц. т. были детально изучены общие закономерности работы тепловых двигателей (внутреннего и внешнего сгорания, турбин), холодильных установок и т.п.
15. Понятие теплоёмкости: удельная, истинная и средняя теплоемкость, их соотношения.
Теплоёмкость - физическая величина, определяющая отношение бесконечно малого количества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT:

Истинная теплоемкость выражается уравнением (2.2) при определенных параметрах термодинамического процесса, то есть в данном состоянии рабочего тела. В частности, если хотят подчеркнуть зависимость теплоёмкости рабочего тела от температуры, то записывают её как  , а удельную – как
, а удельную – как  . Обычно под истинной теплоёмкостью понимают отношение элементарного количества теплоты, которое сообщается термодинамической системе в каком-либо процессе к бесконечно малому приращению температуры этой системы, вызванному сообщенной теплотой. Будем считать
. Обычно под истинной теплоёмкостью понимают отношение элементарного количества теплоты, которое сообщается термодинамической системе в каком-либо процессе к бесконечно малому приращению температуры этой системы, вызванному сообщенной теплотой. Будем считать  истинной теплоёмкостью термодинамической системы при температуре системы равной
истинной теплоёмкостью термодинамической системы при температуре системы равной  , а
, а  - истинной удельной теплоёмкостью рабочего тела при его температуре равной
- истинной удельной теплоёмкостью рабочего тела при его температуре равной  . Тогда среднюю удельную теплоёмкость рабочего тела при изменении его температуры от
. Тогда среднюю удельную теплоёмкость рабочего тела при изменении его температуры от  до
до  можно определить как
можно определить как

|
Уде́льная теплоёмкость (Удельная теплота нагревания на один градус, обозначается как c) вещества определяется как количество тепловой энергии, необходимой для повышения температуры одного килограмма вещества на один градус Цельсия. Единицей СИ для удельной теплоёмкости является Джоуль на килограмм-Кельвин. Следовательно, удельную теплоёмкость можно рассматривать как теплоёмкость единицымассы вещества. На значение удельной теплоёмкости влияет температура вещества. К примеру, измерение удельной теплоёмкости воды даст разные результаты при 20 °C и 60 °C.
Формула расчёта удельной теплоёмкости:  , где
, где  — удельная теплоёмкость,
— удельная теплоёмкость, 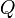 — количество теплоты, полученное веществом при нагреве (или выделившееся при охлаждении),
— количество теплоты, полученное веществом при нагреве (или выделившееся при охлаждении),  — масса нагреваемого (охлаждающегося) вещества,
— масса нагреваемого (охлаждающегося) вещества,  — разность конечной и начальной температур вещества.
— разность конечной и начальной температур вещества.
16. Понятие температуры, формирование температурных шкал Цельсия и Фаренгейта.
Температу́ра - скалярная физическая величина, характеризующая приходящуюся на одну степень свободы среднюю кинетическую энергию частиц макроскопической системы, находящейся в состояниитермодинамического равновесия.
Шкала Цельсия
В технике, медицине, метеорологии и в быту используется шкала Цельсия, в которой температура тройной точки воды равна 0,01 °C, и следовательно точка замерзания воды при давлении в 1 атм равна 0 °C. В настоящее время шкалу Цельсия определяют через шкалу Кельвина: градус Цельсия равен кельвину, t(°С) = Т(К) — 273,15. Таким образом, точка кипения воды, изначально выбранная Цельсием, как реперная точка, равная 100 °C, утратила свое значение, и по современным оценкам температура кипения воды при нормальном атмосферном давлении составляет около 99,975 °C.Шкала Цельсия практически очень удобна, поскольку вода очень распространена на нашей планете и на ней основана наша жизнь. Ноль Цельсия — особая точка для метеорологии, поскольку связана с замерзанием атмосферной воды. Шкала предложена Андерсом Цельсием в 1742 г.
Шкала Фаренгейта
В Англии и, в особенности, в США используется шкала Фаренгейта. Ноль градусов Цельсия — это 32 градуса Фаренгейта, а градус Фаренгейта равен 5/9 градуса Цельсия.
В настоящее время принято следующее определение шкалы Фаренгейта: это температурная шкала, 1 градус которой (1 °F) равен 1/180 разности температур кипения воды и таяния льда при атмосферном давлении, а точка таяния льда имеет температуру +32 °F. Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F — 32), t °F = 9/5 t °С + 32. Предложена Г. Фаренгейтом в 1724.
17. Абсолютные температурные шкалы, их формирование.
Существуют абсолютные термодинамические температурные шкалы (шкала Кельвина) и различные эмпирические температурные шкалы, реализуемые при помощи свойств веществ, зависящих от температуры (тепловое расширение, изменение электрического сопротивления с температурой и др.).
Шкала измерения температуры в соответствии с уравнением называетсяабсолютной шкалой. Ее предложил английский физик У. Кельвин (Томсон) (1824—1907), поэтому шкалу называют также шкалой Кельвина.
До введения абсолютной шкалы температур в практике получила широкое распространение шкала измерения температуры по Цельсию. Поэтому единица температуры по абсолютной шкале, называемая кельвином (К), выбрана равной одному градусу по шкале Цельсия:
1 К = 1 °С
18. Тепловой эффект химической реакции. Понятие стандартной теплоты образования вещества.
Тепловой эффект химической реакции - отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давлении Qp(изобарный процесс).
В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Теплота образования чистых элементов по определению равна нулю.
Определение Т. о. может быть выполнено различными способами: прямыми измерениями; по температурной зависимости константы равновесия реакции образования с помощью изобары или изохоры уравнения; вычислением из теплового эффекта реакции, в которой участвует данное вещество, при условии, что известны Т. о. остальных реагентов и продуктов реакции.
19. Формулировка закона Гесса, его практическое значение и использование.
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы.
Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов.
Закон является частным случаем первого начала термодинамики применительно к химическим реакциям.
20. Закон Кирхгофа о зависимости теплового эффекта реакции от температуры.
В общем случае тепловой эффект химической реакции зависит от температуры и давления, при которых проводится реакция. Влиянием давления на ΔН и ΔU реакции обычно пренебрегают. Влияние температуры на величины тепловых эффектов описывает законКирхгофа:
Температурный коэффициент теплового эффекта химической реакции равен изменению теплоемкости системы в ходе реакции.

где DH=Qp - тепловой эффект, равный изменению энтальпии системы вследствие реакции, DСр - изменениетеплоемкости системы
21. Уравнение энергетического (теплового) баланса объекта. Расчет его составляющих.
Уравнение теплового баланса - уравнение, описывающее теплообмен внутри системы, состоящей из нескольких тел, имеющих первоначально различные температуры.
Уравнение теплового баланса описывает закон сохранения энергии при теплообмене.
Q = m1c1(t'1 - t"1)η = m2c2(t"2 - t'2),
где m1, m2 - расходы горячего и холодного теплоносителей, кг/с;
c1, c2 - их средние, массовые, изобарные теплоемкости, кДж/(кгК);
- КПД теплообменника; индексы: 1, 2 - горячий и холодный теплоносители;
’, ” – индексы входной и выходной температур теплоносителей.
22. Анализ энергобаланса, задачи, решаемые на его основе.
Назначение:
Разработка и анализ энергетических балансов направлены на решение следующих основных задач:
оценка фактического состояния энергоиспользования на предприятии, выявление причин возникновения и определение значений потерь топливно-энергетических ресурсов;
разработка плана мероприятий, направленных на снижение потерь топливно-энергетических ресурсов;
выявление и оценка резервов экономии топлива и энергии;
совершенствование нормирования и разработка научнообоснованных норм расхода топлива и энергии на производство продукции;
определение рациональных размеров энергопотребления в производственных процессах и установках;
определение требований к организации и совершенствованию учета и контроля расхода энергоносителей;
получение исходной информации для решения вопросов создания нового оборудования и совершенствования технологических процессов с целью снижения энергетических затрат, оптимизации структуры энергетического баланса предприятия путем выбора оптимальных направлений, способов и размеров использования подведенных и вторичных энергоресурсов, совершенствования внутрипроизводственного хозяйственного расчета и системы стимулирования экономии топливно-энергетических ресурсов.
В зависимости от назначения энергетические балансы промышленного предприятия могут быть классифицированы по следующим признакам: время разработки, объект энергопотребления, целевое назначение, совокупность видов анализируемых энергетических потоков, способ разработки, форма составления.
В зависимости от времени разработки энергобалансы разделяют на:
проектный, составляемый во время разработки соответствующего проекта;
плановый, составляемый на ближайший планируемый период с учетом заданий по снижению норм расхода энергии;
отчетный (фактический), составляемый по отчетным (фактическим) данным за прошлый период;
перспективный, составляемый на прогнозируемый период с учетом коренных изменений в технологии, организации производства продукции и энергетическом хозяйстве предприятия.
23. Уравнение полного энергетического баланса, расчет его составляющих.
обобщенное, интегральное уравнение энергетического баланса будет иметь вид:

где E - энергия, подводимая к технологической системе от внешних источников с учетом потерь. Эта работа затрачивается непосредственно на изменение энергоемкости обрабатываемой жидкости, в частности ее кинетической энергии движения и внутренней энергии "покоя", например, потенциальной, в случае проявления ощутимой сжимаемости жидкости при высоких давлениях; Eт - тепловая энергия обработанной жидкости; Eнп и Eсф - соответственно энергии, расходуемые на образование новых поверхностей, структурные и фазовые превращения. Например, при гидрорезании - поверхностной энергии частиц, образующихся при микроразрушении абразивных зерен, обрабатываемой поверхности, ее наклепа и т.д., включая структурные изменения самой рабочей жидкости, в частности изменения степени ее эмульгированности для ряда смазочно-охлаждающих жидкостей (СОЖ), в первую очередь на масляной основе, каплеобразование (спрееобразования), парообразование и пр. EАИ - энергия акустического излучения - волн упругой деформации (АЭ); ЕЭМИ - энергия электромагнитного излучения; ЕЭЭЭ - энергия экзоэлектронов; Еу - потенциальная энергия упругих деформаций элементов технологической системы неволновой природы, обусловленная действием статической и квазистатической составляющей полей механических напряжений; Eпр - прочие виды энергии, которыми в первом приближении можно пренебречь, например вторичными акустическими и энергомагнитными излучениями. Заметим, что если энергетический вклад Eпр не велик, то ее информационное значение требует специального анализа в рамках методологии эмиссионной технологической диагностики.
24. Понятие химической энергии и эксергии вещества.
Химическая энергия — потенциал вещества трансформироваться в химической реакции или трансформировать другие вещества. Создание или разрушение химических связей происходит с выделением (экзотермическая реакция) или поглощением (эндотермическая реакция) энергии.
Первым в "истории человечества искусственно вызванным химическим процессом было, пожалуй, горение - разложение при помощи окисления растительной массы, имеющей сложный химический состав, на вещества более простые такие, как вода, углекислый газ и др. Огонь помог человеку использовать и другие химические процессы: именно благодаря огню человек смог сделать свои продукты питания мягче, вкуснее и удобоваримее.
Со временем люди научились использовать не только огонь, но и другие химические процессы. Однако только к концу XVIII века люди овладели законами природы настолько, что научились искусственно вызывать химические процессы и проводить их целенаправленно. Но теперь уже в большинстве случаев целью этих процессов было не разложение вещества, т.е. получение более простых по своему составу соединений, а наоборот, синтез веществ более сложного состава из простых "кирпичиков". Разумеется, химическое разложение сложных веществ ни в коей мере не потеряло своего значения: на нем основана, например, выплавка металлов из руды, при которой металлы высвобождаются из соединений. Продукция многих других отраслей промышленности есть результат разложения вещества сложного состава на более простые. Превращение одних химических веществ в другие сопровождается изменением химической энергии. Целесообразное и хорошо продуманное применение определенных видов энергии дает возможность в границах, установленных объективными законами природы, планомерно управлять химическими реакциями. На этой основе в последнее время стремительно развивается химическая промышленность, требующая все больших затрат энергии.
ЭНЕРГИЯ = ЭКСЕРГИЯ + АНЕРГИЯ
ЭКСЕРГИЯ - это высококачественная энергия тела, которая может производить полезную работу.
АНЕРГИЯ - это низкокачественная энергия окружающей среды.
В конечном итоге вся высококачественная энергия - "ЭКСЕРГИЯ"
превращается в низкокачественную энергию окружающей среды – в "анергию".
28. Органические топлива, их классификация, основные характеристики.
ТОПЛИВО, в широком смысле – любой горючий материал, который, вступая в реакцию с кислородом, выделяет теплоту. На практике топливом считают только те вещества, которые воспламеняются при умеренной температуре, имеют высокую теплотворную способность и могут быть получены в достаточном количестве доступными средствами.
К топливам органического происхождения относятся торф, лигниты, каменные и антрацитные угли, нефть и природный газ. Эти материалы часто называют ископаемыми топливами, так как они являются конечными продуктами физико-химических превращений окаменевших остатков растений. Сравнение составов различных топлив показывает, что относительное содержание углерода по сравнению с содержанием водорода уменьшается при переходе от твердых топлив к жидким и далее к газообразным. Все эти топлива можно получать друг из друга, изменяя соотношение между содержанием углерода и водорода. Все они являются ценным сырьем для производства различных химических продуктов, горючего для двигателей и масел для смазки, а также служат источниками тепла и электрической энергии.
29. Методы определения теплоты сгорания топлив. Жаропроизводительность топлива.
Теплота́ сгора́ния — это количество выделившейся теплоты при полном сгорании массовой (для твердых и жидких веществ) или объёмной (для газообразных) единицы вещества. Измеряется в джоулях или калориях. Теплота сгорания, отнесённая к единице массы или объёма топлива, называется удельной теплотой сгорания (дж или кал на1 кг, м³ или моль).
Для её измерения пользуются методами калориметрии. Теплота сгорания определяется химическим составом горючего вещества. Содержащиеся в горючем веществехимические элементы обозначаются принятыми символами С, Н, О, N, S, а зола и вода — символами А и W соответственно.
Различают высшую (QB) и низшую (QH) теплоту сгорания.
Под высшей теплотой сгорания понимают то количество теплоты, которое выделяется при полном сгорании вещества, включая теплоту конденсации водяных паров при охлаждении продуктов сгорания.
Низшая теплота сгорания соответствует тому количеству теплоты, которое выделяется при полном сгорании, без учёта теплоты конденсации водяного пара. Теплоту конденсации водяных паров также называют скрытой теплотой сгорания.
Низшая и высшая теплота сгорания связаны соотношением: QB = QH + k(W + 9H),
где k — коэффициент, равный 25 кДж/кг (6 ккал/кг); W — количество воды в горючем веществе, % (по массе); Н — количество водорода в горючем веществе, % (по массе).
Жаропроизводительностью обычно называется максимальная температура горения, развиваемая при полном сгорании топлива без избытка воздуха. Термин предложен Д.И. Менделеевым. Чем выше жаропроизводительность топлива, тем выше качество тепловой энергии, выделяющейся при его сжигании, тем выше эффективность работы паровых и вододогрейных котлов.
Жаропроизводительность сухой древесины составляет около 2000 С, что сопоставимо с жаропроизводительностью жидкого топлива.
30. Возобновляемые источники энергии, проблемы и перспективы их практического использования.
Возобновляемая энергия — энергия из источников, которые по человеческим масштабам являются неисчерпаемыми. Основной принцип использования возобновляемой энергии заключается в её извлечении из постоянно происходящих в окружающей среде процессов и предоставлении для технического применения.
Возобновляемую энергию получают из природных ресурсов — таких как солнечный свет, ветер, дождь, приливы и геотермальная теплота — которые являются возобновляемыми (пополняются естественным путем). В 2006 году около 18 % мирового потребления энергии было удовлетворено из возобновляемых источников энергии, причем 13 % из традиционной биомассы, таких, как сжигание древесины. Гидроэлектроэнергия является очередным крупнейшим источником возобновляемой энергии, обеспечивая 3 % мирового потребления энергии и 15 % мировой генерации электроэнергии.[1]
Примеры возобновляемой энергии:
1.1 Энергия ветра
1.2 Гидроэнергия
1.3 Энергия приливов и отливов
1.4 Энергия солнечного света
1.5 Геотермальная энергия
1.6 Биоэнергия
31. Принципиальная схема и оборудование конденсационной электростанции.
Конденсаци о нная электрост а нция (КЭС), тепловая паротурбинная электростанция, назначение которой — производство электрической энергии с использованием конденсационных турбин. На КЭС применяется органическое топливо: твердое топливо, преимущественно уголь разных сортов в пылевидном состоянии, газ, мазут и т. п.

Оборудование:
котельная установка;
паротурбинная установка;
топливное хозяйство;
система золо- и шлакоудаления, очистки дымовых газов;
электрическая часть;
техническое водоснабжение (для отвода избыточного тепла);
система химической очистки и подготовки воды.
32. Принципиальная схема и оборудование теплоэлектроцентрали.
ТЭЦ - тепловая электростанция, вырабатывающая электрич. энергию и теплоту, отпускаемую потребителям в виде пара и горячей воды. Использование отра-бот. теплоты паровой турбины является отличит, особенностью ТЭЦ и наз. теплофикация. Комбиниров. произ-во энергии двух видов способствует более экономичному использованию топлива по сравнению с его использованием при раздельной выработке электроэнергии на конденсац. электростанциях (ГРЭС) и тепловой энергии в котельных установках.


33. Принципиальная схема и оборудование газотурбинной электростанции.

Принципиальная технологическая схема электростанции с газовыми турбинами:
КС - камера сгорания; КП — компрессор; ГТ - газовая турбина; С - генератор;
Т - трансформатор; М - пусковой двигатель.
Топливо (газ, дизельное горючее) подается в камеру сгорания, туда же компрессором нагнетается сжатый воздух. Горячие продукты сгорания отдают свою энергию газовой турбине, которая вращает компрессор и синхронный генератор. Запуск установки осуществляется при помощи разгонного двигателя и длится 1—2 мин, в связи с чем газотурбинные установки (ГТУ) отличаются высокой маневренностью и пригодны для покрытия пиков нагрузки в энергосистемах. Основная часть теплоты, получаемая в камере сгорания ГТУ, выбрасывается в атмосферу, поэтому общий КПД таких электростанций составляет 25 –30 %.
34. Принципиальная схема и оборудование парогазовых электростанций.
Парогазовая установка — электрогенерирующая станция, служащая для производства электроэнергии. Отличается от паросиловых и газотурбинных установок повышенным КПД.
Парогазовые электростанции - сочетание паровых и газовых
турбин. Это объединение позволяет снизить потери тепловой
энергии в газовых турбинах или теплоты уходящих газов
паровых котлов. Тем самым обеспечивается повышение КПД
(до 43%) по сравнению с отдельно взятыми паротурбинными и
газотурбинными установками.
Парогазовые электростанции используют два вида рабочего
тела - пар и газ - и относятся к классу бинарных установок.
Применяется жидкое топливо (мазут) или газ (природный).
35. Экологические проблемы тепловых электростанций на органическом топливе.
Одной из актуальных проблем отечественной электроэнергетики является сокращение выбросов оксидов азота. На электростанциях отрасли, особенно на газомазутных котлах, широко распространены различные технологические методы очистки дымовых газов от NOx. На ряде ТЭС осваиваются технологии селективного каталического восстановления.
Проблема сероочистки дымовых газов ТЭС имеет приоритетное значение для нескольких особо сернистых углей (интинского, донецкого, подмосковного, челябинского) и мазутных ТЭС.
Сокращение выбросов золы на объектах электроэнергетики за последние годы достигнуто в основном также за счет уменьшения потребления твердого топлива и за счет очистки газов. Тепловые электростанции отрасли оснащены электрофильтрами (164 котельные установки) и мокрыми золоуловителями с коагуляторами Вентури (более 400 котлов). Ведутся работы по созданию более совершенных электрофильтров с целью повышения эффективности золоулавливания, надежности и ресурса работы, сокращения расхода электроэнергии и трудозатрат на обслуживание и ремонт.
36. Принципиальные схемы и оборудование атомных электростанций.
А́томная электроста́нция (АЭС) — ядерная установка для производства энергии в заданных режимах и условиях применения, располагающаяся в пределах определённой проектом территории, на которой для осуществления этой цели используются ядерный реактор (реакторы) и комплекс необходимых систем,устройств, оборудования и сооружений с необходимыми работниками.

1 – реактор, 2-испарительный канал, 3-пароперегревательный канал, 4-барабан-сепаратор, 5-циркуляционный насос, 6-деаэратор, 7-турбина, 8-конденсатор, 9-конденсатный насос, 10-регенеративный подогреватель низкого давления, 11-питательный насос, 12-регенеративные подогреватели высокого давления, 13-генератор электрического тока.
37. Экологические проблемы атомных электростанций.
Очень важная задача состоит в обеспечении полной радиационной безопасности людей, работающих на атомных электростанциях, и предотвращении случайных выбросов радиоактивных веществ, которые в большом количестве накапливаются в активной зоне реактора. При разработке ядерных реакторов этой проблеме уделяется большое внимание. Однако ядерной энергетике, как и многим другим отраслям промышленности, присущи вредные и опасные факторы воздействия на окружающую среду. Наибольшую потенциальную опасность представляет радиоактивное загрязнение.
Сложные проблемы возникают с захоронением радиоактивных отходов и демонтажем отслуживших свой срок АЭС. Наиболее известными среди продуктов распада являются стронций и цезий. Блоки отработанного ядерного топлива необходимо охлаждать. Дело в том, что при радиоактивном распаде выделяется так много тепла, что блоки могут расплавиться. Кроме того, блоки могут излучать новые радиоактивные элементы. Отходы помещают в специальные контейнеры, которые закапывают в выработанные шахты или расселины в скалах.
38. Основное оборудование русловых гидроэлектростанций, их классификация.
Изобретение относится к гидроэнергетике и может быть использовано для производства электроэнергии в русловых потоках малых рек.
Использование: в гидротехническом строительстве, в частности в создании русловой электростанции для производства электроэнергии в русловых потоках малых рек.
В русловых ГЭС напор воды создаётся плотиной, перегораживающей реку и поднимающей уровень воды в верхнем бьефе. При этом неизбежно некоторое затопление долины реки. В случае сооружения двух плотин на том же участке реки площадь затопления уменьшается. На равнинных реках наибольшая экономически допустимая площадь затопления ограничивает высоту плотины. Русловые ГЭС строят и на равнинных многоводных реках и на горных реках, в узких сжатых долинах.
В состав сооружений русловой ГЭС, кроме плотины, входят здание ГЭС и водосбросные сооружения
У русловой ГЭС здание с размещенными в нём гидроагрегатами служит продолжением плотины и вместе с ней создаёт напорный фронт. При этом с одной стороны к зданию ГЭС примыкает верхний бьеф, а с другой — нижний бьеф. Подводящие спиральные камеры гидротурбин своими входными сечениями закладываются под уровнем верхнего бьефа, выходные же сечения отсасывающих труб погружены под уровнем нижнего бьефа.
к простейшим русловым ГЭС относятся также ранее строившиеся сельские ГЭС небольшой мощности.
Русловые ГЭС могут изготавливаться в нескольких вариациях.Это могут быть отдельные блоки рассчитанные на небольшие мощности.
Можно сооружать каскад широких станций занимающих всю ширину реки.
39. Особенности сооружения и работы деривационных гидроэлектростанций.
| |
| |
|
40. Особенности сооружения и работы гидроаккумулирующих электростанций.
Гидроаккумулирующая электростанция (ГАЭС), насосно-аккумулирующая электростанция, гидроэлектрическая станция, принцип действия (аккумулирования) которой заключается в преобразовании электрической энергии, получаемой от др. электростанций, в потенциальную энергию воды; при обратном преобразовании накопленная энергия отдаётся в энергосистему главным образом для покрытия пиков нагрузки. Гидротехнические сооружения ГАЭС (рис.) состоят из двух бассейнов, расположенных на разных уровнях, и соединительного трубопровода. Гидроагрегаты, установленные в здании ГАЭС у нижнего конца трубопровода, могут быть трёхмашинными, состоящими из соединённых на одном валу обратимой электрической машины (двигатель-генератор), гидротурбины и насоса, или двухмашинными — обратимая электромашина и обратимая гидромашина, которая в зависимости от направления вращения может работать как насос или как турбина.
41. Экологические проблемы ГЭС.
ГЭС традиционно считались сравнительно дешевым и чистым источником энергии. Сооружение плотин неизбежно связано с образованием крупных искусственных водоемов.
эти искусственные озера постепенно, но неизбежно мелеют, зацветают, заболачиваются, становятся причиной изменения климата в худшую сторону. У плотин ГЭС гибнет в огромных количествах животный и растительный мир рек. Количество рыбы, уничтожаемой на водозаборах ГЭС, многократно превышает то, что дают все рыбные предприятия страны.
В нижний бьеф вода попадает через турбины и по водоводам. На высотных плотинах (100 – 200 м) водоводы расположены на большой глубине (несколько десятков или более сотни метров), где вода летом и зимой имеет постоянную температуру. В условиях Сибири это приводит к тому, что летом в реке вода очень холодная - 6 -10 градусов при температуре на поверхности водохранилища 20 градусов. При коротком сибирском лете жители не имеют возможности искупаться в такой реке. Зимой река за плотиной не замерзает, так как через водовод попадает вода теплая – 4 градуса. Незамерзающий “язык” достигает 100 – 200 км, открытый водоем повышает влажность воздуха, при лютых сибирских морозах происходит кристаллизация льдинок в воздухе. Человек тяжело переносит сильные морозы с повышенной влажностью.
42. Особенности сооружения и работы приливных электростанций.
Приливная электростанция (ПЭС), электростанция, преобразующая энергию морских приливов в электрическую. ПЭС использует перепад уровней «полной» и «малой» воды во время прилива и отлива. Перекрыв плотиной залив или устье впадающей с море (океан) реки (образовав водоём, называют бассейном ПЭС), можно при достаточно высокой амплитуде прилива (> 4 м) создать напор, достаточный для вращения гидротурбин и соединённых с ними гидрогенераторов, размещенных в теле плотины. Для устранения неравномерности выработки электроэнергии бассейн ПЭС можно разделить плотиной на два или три меньших бассейна, в одном из которых поддерживается уровень «малой», а в другом — «полной» воды; третий бассейн — резервный; гидроагрегаты устанавливаются в теле разделительной плотины. На ПЭС устанавливают капсульные гидроагрегаты, которые могут использоваться с относительно высоким кпд в генераторном (прямом и обратном) и насосном (прямом и обратном) режимах, а также в качестве водопропускного отверстия.
Использование приливной энергии ограничено главным образом высокой стоимостью сооружения ПЭС.
43. Схемы и основное оборудование для использования солнечной радиации с целью получения тепловой энергии разного потенциала.
Со́лнечная радиа́ция — электромагнитное и корпускулярное излучение Солнца.
Тепловая гелиоустановка — набор оборудования для трансформации солнечной энергии в тепловую энергию. Основной задачей поставленной перед гелиоустановками (солнечными коллекторами) является нагрев хозяйственной воды в системе горячего водоснабжения. Существуют также комбинированные установки которые позволяют не только нагревать воду в системах ГВС, но и участвовать в работе систем отопления, систем подогрева плавательных бассейнов и т.д.
Плоский коллектор - Основными конструктивными элементамм плоского солнечного коллектора является пластина-поглатитель с титановым покрытием и расположенный под ней медный трубопровод по которому циркулирует теплоноситель гелиоустановки. При относительно не высокой стоимости гелиоустановок в составе которых применяются плоские солечные коллекторы, их использование, к сожалению, сильно зависит от погодных условий и колличества солнечных дней в году. Для южных регионов эффективность плоских коллекторов значительно выше, чем скажем для средней полосы России, где их целесообразно использовать в ограниченном интервале с апреля по октябрь.
Трубчатый коллектор
44. Схемы и основное оборудование для получения электроэнергии за счет солнечной радиации.
Солнечная энергетика — направление нетрадиционной энергетики, основанное на непосредственном использовании солнечногоизлучения для получения энергии в каком-либо виде. Солнечная энергетика использует неисчерпаемый источник энергии[1] и является экологически чистой, то есть не производящей вредных отходов[2].
Получение электроэнергии с помощью фотоэлементов.
Преобразование солнечной энергии в электричество с помощью тепловых машин:
паровые машины (поршневые или турбинные), использующие водяной пар, углекислый газ, пропан-бутан, фреоны;
двигатель Стирлинга и т. д.
45. Принципиальные схемы и оборудование для использования ветровой энергии.
Ветровые установки являются одним из самых перспективных и одновременно экологически чистых способов выработки электроэнергии. Вместе с тем, энергия ветра относится к числу возобновляемых источников энергии. Возобновляемые ресурсы — природные ресурсы, запасы которых или восстанавливаются быстрее, чем используются, или не зависят от того, используются они или нет.
СХЕМА ВЕТРОГЕНЕРАТОРА

46. Способы транспортировки различных форм энергии, масштабы и перспективы.
Некоторые энергоресурсы, например жидкие или газообразные топлива, могут быть транспортированы на танкерах или по трубопроводам. Для передачи электричества необходима сеть линий электропередачи.
47. Трубопроводный транспорт топлив и энергии, масштабы и перспективы
Наряду с аккумулированием теплоты можно аккумулировать и некоторые другие виды энергии:
-потенциальную энергию (энергию, получаемую в результате перекачивания воды на более высокую отметку, энергию сжатого воздуха и энергию гейзеров);
-химическую энергию с использованием водорода в жидкой или газообразной форме или аккумуляторных батарей;
-кинетическую энергию (с помощью маховых колес);
-электромагнитную энергию (с помощью конденсаторов или сверхпроводящих магнитов).
Дата добавления: 2015-08-20; просмотров: 122 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Параметры для описания состояния термодинамической системы процессов, их классификация. | | | Выезд: 30.12.2014-02.01.2015 |