
Читайте также:
|
Физический смысл магнитного квантового числа заключается в следующем. В спектрах атомов, помещенных во внешнее магнитное поле, обнаруживается дополнительное расщепление спектральных линий. Возникновение новых близколежащих линий свидетельствует о том, что в магнитном поле энергия электронов изменяется. Но это возможно только в случае различной взаимной ориентации электронных облаков. Обнаружилось, что все s-подуровни в несильном постоянном магнитном поле не расщепляются. Это говорит о том, что s-электронное облако имеет шаровую симметрию (рис. 2.3, а). р-подуровни расщепляются в магнитном поле на три близкие линии. Это указывает на три различных типа ориентации р-облаков в пространстве. Расчеты показывают, что область максимального значения квадрата волновой функции р-орбиталей имеет форму, напоминающую гантель. Так как возможны три различных направления р-орбиталей в пространстве, то удобно их расположить вдоль координатных oceй и обозначить рx, ру и рz.бd-подуровень дает в магнитном поле пять близколежащих линий, что указывает на пять различных способов их ориентации в пространстве. Форма d-облаков значительно сложнее формы р-облаков. Четыре d-облака схожи по внешнему виду между собой, каждое из них как бы составлено из двух расположенных под прямым углом гантелей.
Спиновое квантовое число (спин электрона) в первом приближении характеризует собственное (не орбитальное) внутреннее движение электрона
2) При повышении температуры в значительной степени увеличивания скорость химических реакций. Это увеличение можно характеризовать при помощи температурного коэффициента скорости реакции, который представляет собой отношение констант скоростей при изменении температуры на 10°. По приближенному правилу (эмпирическое правило Вант Гоффа) повышение температуры на 10° вызывает увеличение скорости реакции примерно в 2 — 4 раза. Более точно зависимость скорости реакции от температуры выражается уравнением Аррениуса. Уравнение показывает, что логарифм отношения констант находится в линейной зависимости от величины, обратной температуре (1/Т). Экспериментальные исследования показывают, что, пользуясь уравнением Аррениуса, можно достаточно точно определить действительные изменения скорости реакций с изменением температуры. Таким образом, для химических процессов, протекающих в организме, выявляется так называемый «температурный оптимум», который для теплокровных животных лежит в интервале примерно 36—42° С.
Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции — числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры системы на 10 градусов. Температурный коэффициент различных реакций различен. При обычных температурах его значение для большинства реакций лежит в пределах от 2 до 4. Это на первый взгляд небольшое значение температурного коэффициента обусловливает, однако, большое возрастание скорости реакции при значительном повышении температуры. Например, если температурный коэффициент равен 2,9, то при возрастании температуры на 100 градусов скорость реакции увеличивается на 2,9'°, т. е, приблизительно в 50000 раз.
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале -(обычно от 0 °C до 100 °C). Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде
|
Уравне́ние Арре́ниуса устанавливает зависимость константы скорости 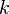 химической реакции от температуры
химической реакции от температуры 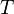 .
.
Билет №7.
1. Правило Клечковского (также Правило n+l; также используется название правило Маделунга) — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах.
Правило Клечковского гласит:
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел ~n+l. При одинаковой сумме раньше заполняется орбиталь с меньшим значением ~n.
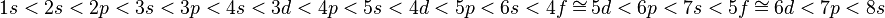
Пример: заполнение Скандия:
Что должно заполняться первый 3d-или 4s-подуровне?
Подсчитаем сумму:
3d ^ (n = 3; l = 2, Z = 5); 4s ^ (n = 4; l = 0; Z = 4). Итак, 4s-подуровень должен заполняться раньше, чем 3d-.
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делят на s-, p-, d-, f- семейства.
1. У элементов s-семейства (или s-элементов) заполняется электронами s-подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. Например, согласно правилу Клечковского, электронная формула элемента четвертого периода кальция имеет вид:
20Ca 1s22s22p63s23p64s2 – это s-элемент.
2. У элементов p-семейства (или p-элементов) заполняется электронами p-подуровень внешнего уровня. Это последние шесть элементов каждого периода. Например, по правилу Клечковского, электронная формула элемента четвертого периода галлия имеет вид:
31Ga 1s22s22p63s23p64s23d10 4p1 – это p-элемент.
3. У элементов d-семейства (или d-элементов) заполняется электронами d-подуровень второго снаружи уровня, а на внешнем уровне остается один или два (s) электрона (у Pd – ноль). К ним относятся элементы вставных декад больших периодов, расположенных между s и p-элементами (их также называют переходными элементами). Например, по правилу Клечковского, электронная формула элемента пятого периода иттрия имеет вид:
39Y 1s22s22p63s23p64s23d10 4p65s24d1 – это d-элемент
4. У элементов f-семейства (или f-элементов) заполняется электронами f-подуровень третьего снаружи уровня, а на внешнем уровне остается два s-электрона. Это лантаноиды и актиноиды.Например, по правилу Клечковского, электронная формула лантаноида неодима имеет вид:
60Nd 1s22s22p63s23p64s23d10 4p65s2 4d10 5p6 6s24f4 – это f- элемент
Скорость химических реакций может возрастать не только при
увеличении концентрации реагирующих веществ или температуры
системы, но и под влиянием катализаторов.
Катализатором называется вещество, изменяющее скорость
химической реакции, но в результате реакции остающееся без
изменений.
Процесс изменения скорости реакции за счет введения
катализатора называется катализом, а реакции называются
каталитическими.
Положительным считается катализ, приводящий к ускорению
химической реакции, а отрицательным – приводящим к замедлению
химической реакции.
Катализ гомогенный, если катализатор и реагирующие вещества
находятся в одной фазе (газы, раствор).
Пример: А + В = АВ; SO2 (г) + 1/2O2 (г) = SO3 (г) (медленно).
Катализ гетерогенный, если реагирующие вещества и
катализатор образуют систему из разных фаз. В этом случае между
катализатором и реагирующими веществами существует поверхность 106
раздела. Обычно катализатор – твердое вещество, а реагирующие
вещества – газы или жидкость.
Пример: 2HJ → H2 + J2
Изменение скорости катализируемой гомогенной реакции за
счет снижения энергии активации ее отдельных стадий можно
рассмотреть на следующем примере. Допустим, между веществами А
и В возможно взаимодействие с образованием соединения АВ (G˂0):
А + В → А … В → АВ (медленно).активированный комплекс
Но в силу высокой энергии активации эта реакция протекает с
очень малой, практически равной нулю скоростью. Пусть, с другой
стороны, найдено такое третье вещество К (катализатор), которое
легко вступает во взаимодействие с А (в силу другой природы
реагирующих веществ, а следовательно, другой, меньшей, энергии
активации), образуя соединение АК:
А + К → А … К → АК (быстро). Активированный комплекс
Соединение же АК легко взаимодействует с веществом В
(опять-таки в силу иной природы веществ и малой энергии
активации), образуя вещества АВ и К:
В + АК → В…АК → АВ + К (быстро).
активированный
комплекс
Суммируя два последних уравнения, получим
А + В → АВ,
т.е. в результате реакции катализатор остался без изменения.
БИЛЕТ 8.
1.1 \1.2 Многоэлектронный атом. Принцип Паули
В многоэлектронном атоме, заряд которого равен Ze, электроны будут занимать различные «орбиты» (оболочки). При движении вокруг ядра Z-электроны располагаются в соответствии с квантово-механическим законом, который называется принципом Паули (1925 г.). Он формулируется так:
n, орбитального /, магнитного m и магнитного спинового ms.
2 электронов.
Значит, на первой оболочке («орбите») могут находиться только 2 электрона, на второй – 8, на третьей – 18 и т. д.
Таким образом, совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой. В каждой из оболочек электроны располагаются по подоболочкам, которые соответствуют определенному значению /. Так как орбитальное квантовое число l принимает значения от 0 до (п – 1), число подоболочек равно порядковому номеру оболочки п. Количество электронов в подоболочке определяется магнитным квантовым числом ml и магнитным спиновым числом ms.
Принцип Паули сыграл выдающуюся роль в развитии современной физики. Так, например, удалось теоретически обосновать периодическую систему элементов Менделеева. Без принципа Паули невозможно было бы создать квантовые статистики и современную теорию твердых тел.
1.3 Максимальное число электронов, которое может находиться на определенном энергетическом уровне, можно вычислить по формуле 2n2, где n - номер энергетического уровня. А максимальное количество электронов на энергетическом подуровне (орбитали) определяется по формуле 2(2l+1), где (2l+1) – число орбиталей на подуровне, соответствующее числу ml, а коэффициент 2 учитывает спиновое число электронов
2.1 Химическое равновесие устанавливается в гомогенной и гетерогенной средах. В гомогенной среде (газовая смесь, растворы) константу равновесияможно выразить через концентрации реатирующих веществ, парциальные давления, мольные доли, летучести и активности. Равновесие гетерогенных процессов определяется константой равновесия химических реакций, законом распределения компонентовмежду фазами и правилом фаз. Равновесие между исходными реагентами ипродуктами химической реакции, происходящей в одной из фаз, определяется константой равновесия Кр, Кс или Kw так же, как и для гомогенных процессов.
Дата добавления: 2015-08-17; просмотров: 378 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Какой пурифайер выбрать? | | | Константа химического равновесия |