
Читайте также:
|
металлизации железорудных материалов в шахтной печи
Исходные данные. В качестве сырья выбраны окатыши следующего состава. Химический состав окисленных железорудных окатышей (% по массе): 68,00 Fe; 96,59 Fe203; 0,50 FeO; 2,49 Si02; 0,08 A1203; 0,20 CaO; 0,06 MgO; 0,04 MnO; 0,02 P205; 0,02 S03; X = 100,0.
Определяем состав металлизованных окатышей. Задаемся величиной степени металлизации riMeT (колеблется чаще всего в пределах 85—95%). Принято riMer = 90%. Тогда при переработке 100 кг окисленных окатышей образуется металлического железа 68 0,9 = 61,2 кг (принято допущение об отсутствии трехвалентного железа): (68-61,2)-(72/56) = 8,74 кг.
Остается: 2,49 кг Si02; 0,08 кг А1203; 0,20 кг СаО; 0,06 кг MgO; 0,04 кг МпО; 0,02 кг P2Os: 0,02 кг S03. Масса металлизованных окатышей 72,85 кг.
Состав металлизованных окатышей, %[i]: 93,33 Fe; 84,00 FeMeT; 12,OOFeO; 3,42 SiO; 0,11
A1203; 0,27 CaO; 0,08 MgO; 0,06 MnO; 0,03 P205; 0,03 S03; £ =100.
Расход окисленных окатышей на единицу металлизованного сырья у = 100:72,85 = 1,37 кг/кг.
Задаемся составом восстановительного газа (определяется расчетом конверсии природного газа или, исходя из производственных данных, в данном расчете принят состав газа углекислотной конверсии).
Состав восстановительного газа, % по объему: 1,90 СН4; 33,60 СО; 2,50 С02; 54,10 Н2; 5,30 Н20; 2,60 N2; I = 100.
Степень использования восстановительной способности газа т)г Принимаем т]со = г]Н2 - т]г (колеблется чаще всего в интервале 0,3—0,4). В расчете принято г|г = 0,35.
Температура колошникового газа tK г изменяется в пределах 200—400 °С. Задаемся /кг=300 °С. Температура восстановительного газа /вг зависит от условий процесса и изменяется от 700 до 1000 °С. В расчете принято tB г = 760 °С. Теплоемкость компонентов восстановительного и колошникового газов приведена в табл. 4.21 и 4.22.
Определение расхода восстановительного газа
Расчет ведется на 100 кг металлизованных окатышей.
требуется два объема СО или Н2. С учетом степени участия газа-восстановителя в восстановительном процессе г)г:
VC0+h2= 2voJ\= 2-26,03/0,35 = 148,74 нм3.
Теплоемкость компонентов газов (числитель – ккал/н 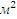 ,
,
Знаменатель – кДж/ 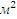 )
)
| Компонент | Восстановительный газ (760ᵒС) | Колошниковый газ(300ᵒС) |
C 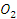 CO
CO
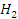
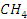
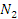
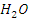
| 0,5069/2,1188 0,3296/1,3777 0,132/1,3092 0,5931/2,4792 0,3251/1,3589 0,3967/1,6582 | 0,4452/1,8609 0,3148/1,3159 0,3108/1,2991 0,4510/1,8852 0,3124/1,3058 0,3687/1,5412 |
Состав восстановительного газа, % по объему/ н  /кг
/кг
| Компонент | Состав газа | Компонент | Состав газа |
CO
C 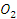
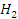
| 33,60/56,90/71,24 2,50/4,24/8,32 54,10/91,75/8,19 | 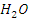
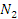
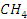
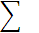
| 5,30/8,99/7,22 2,60/4,41/5,51 1,90/3,22/2,30 100/169,60/102,5 |
Расход восстановительного газа 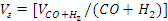 ·100=169,60 н
·100=169,60 н 

Расчет состава колошникового газа (табл.4.24)
Количество водорода, переходящего в колошниковый газ,
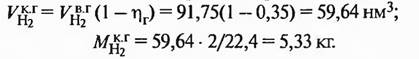
Израсходовано водорода на восстановление и перешло в 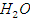
Таблица 4,24
Состав колошникового газа, н  /кг/% по объему
/кг/% по объему
| Компонент | Состав газа | Компонент | Состав газа |
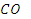
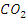
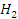
| 37,05/46,31/21,85 24,18/47,50/14,26 59,64/5,33/35,17 | 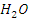
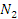
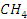
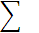
| 41,10/32,88/24,33 4,41/5,51/2,60 3,22/2,30/1,90 169,60/139,83/100,00 |
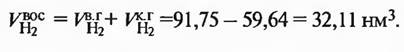
Количество водяных паров в колошниковом газе:
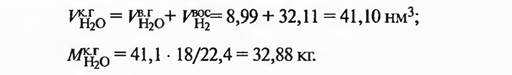
Объем кислорода кислорода,отнятого от оксидов железа водородом:
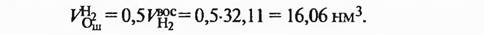
Объем кислорода, отнятого от оксидов железа оксидом углерода:
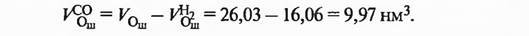
Объем оксида углерода, израсходованного на восстановление:
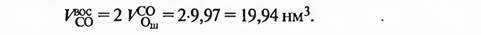
Количество оксида углерода, переходящего в колошниковый газ:

Количество диоксида углерода, переходящего в колошниковый газ:
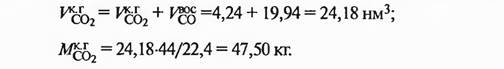
Количество азота в колошниковом газе:
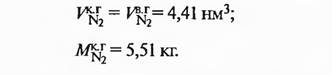
Количество метана в колошниковом газе:
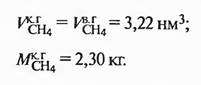
Проверка степени использования восстановительной способности газа
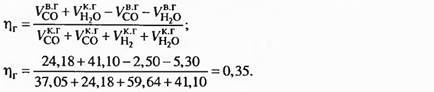
Материальный баланс процесса
Поступило в печь: Получено в печи:
Окисленные окатыши 137 кг Металлизованные окатыши 100кг
Восстановительный газ 102,75 кг Колошниковый газ 139,83 кг
Итого 239,75 кг Итого 239,83 кг
Невязка баланса: (139,83-139,750)·100/139,89=0,05%
Допускается невязка до 0,3%
Тепловой баланс процесса
Приход тепла
Тепло восстановительного газа:
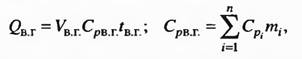
Где С-теплоемкость i-го компонента газа; m-концентрация i-го компонента газа.
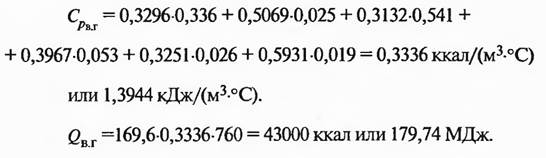
Расход тепла
Физическое тепло металлизованных окатышей Q=100  .
.
Обычно температура металлизованных окатышей на выходе из зоны восстановления на 10-40ᵒС ниже температуры восстановительного газа. Принимаем 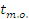 =750C.
=750C.
Теплоемкость металлических железа
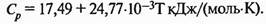
Для 750 °С – d
Ср = 17,49 + 24,77– 10–3·1023 = 42,83 или 42,83/56 = 0,7648 кДж/(кг·К) = 0,183 ккал/(кг·°С);
Qm.o= 100·0,183–750 =13725 ккал или 57,37 МДж.
Расход тепла на восстановление оксидов
Тепловые эффекты реакций восстановления:
Fe2O3+ СО = 2FеО + СO2– 370 ккал (1547 кДж) или
23 ккал/кгO2 (97 кДж/кг 02);
Fe2O3+ Н2 = 2FеО + Н2O–10240 ккал (42803 кДж) или
640 ккал/кг O2 (2675 кДж/кг O2);
FeO + СО = Fе + СO2+ 3250 ккал (13585 кДж) или
203 ккал/кг O2 (848 кДж/кг 02);
FeO + Н2= Fе + Н2O– 6620 ккал (27670 кДж) или
413 ккал/кг O2 (1729 кДж/кг 02).
Количество кислорода, отнимаемого от шихты при восстановлении Fe203до FeO, равно одной трети всего поступающего кислорода, связанного с трехвалентным железом:
Fe2O3→ FeO =(48/160)·96,59·1,37·1/3=13,232 кг.
Количество кислорода, отнимаемого от шихта при восстановлении FeO до Fe:
MОшFeO→Fe=MОш–MОшFe2O3→ FeO= 37,185 –13,232 = 23,953 кг.
Доли СО и Н2 в сумме восстановителей (СО + Н2) в восстановительном газе:
% СО = (СОв г)/(СОв г + Н2 в г) = 33,60/(33,60 + 54,10)100 = 38,31%;
% Н2 = Н2 вг/(СОвг + Н2вг) = 54,10/(33,60 + 54,10)100 = 61,69%.
Количество кислорода оксидов железа, отнимаемого СО и Н2 при восстановлении Fе2О3до FeO (принято допущение о том, что количество отнимаемого кислорода пропорционально доле данного восстановителя):
O2CO= 13,232·0,3831 = 5,069 кг;
O2H2= 13,232·0,6169 = 8,163 кг.
Количество кислорода оксидов железа, отнимаемого СО и Н2 при восстановлении FеО до Fе:
O2СО = 23,953·0,3831 = 9,176 кг;
O2Н2= 23,953·0,6169 = 14,777 кг.
Расход тепла на восстановление Fe2O3до FеО:
QCOFe2O3→ FeO= 5,069·23 = 117 ккал (489 кДж);
QH2Fe2O3→ FeO = 8,163·640 = 5224 ккал (21836 кДж);
QFe2O3→ FeO= 117 + 5224 = 5341 ккал (22325 кДж).
Расход тепла на восстановление FеО до Fе:
QCOFeO→Fe= 9,176(–203) = –1863 ккал (7787 кДж);
QH2FeO→ Fe= 14,777·413 = 6103 ккал (25511 кДж);
QFeO→ Fe= 6103–1863 = 4240 ккал (17723 кДж).
Расход тепла на процесс восстановления:
Qэнд.р = 5341 + 4240 = 9581кккал(40049кДж)
Тепло колошникового газа Qк.г= Vк.гCрк.г.tк.гПо аналогии:
Cк.г = 0,3148·0,2185 + 0,4452·0,1426 + 0,3108·0,3577 +0,3687·0,2423 + +0,3124·0,026 + 0,451·0,019 = 0,3475; Qк.г=169,6·0,3475·300 = 17681 ккал (73907 кДж).
Общий расход тепла
Qрасх = Qm.o + Qэнд.р + Qк.г = 13725 + 9581 + 17681 = 40987 ккал (171326 кДж),
Оценкой точности расчета теплового баланса является величина тепловых потерь, в которую входит и невязка расчета:
Qпот = Qв.г–Qрасх = 43000–40987 = 2013 ккал (8414 кДж) или (2013/43000)100 = 4,68%,
что находится в пределах допустимого (4–10%). В случае завышения величины потерь следует повысить температуру колошникового газа. Если потери меньше допустимых или составляют отрицательную величину, следует снизить температуру колошникового газа (в пределах 200–400 °С) или увеличить количество восстановительного газа. В этом случае степень использования восстановительного газа понизится.
Тепловой баланс процесса(на 100 кг металлизованных окатышей)
Дата добавления: 2015-08-20; просмотров: 85 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| КИСЛОРОДНОЙ КОНВЕРСИИ ПРИРОДНОГО ГАЗА | | | Установки |