
Читайте также:
|
Окислительно-восстановительные методы являются разновидностью реагентного способа очистки и подготовки воды.


В их основе лежит способ использования различных соединений для осуществления химических реакций. В качестве реагентов применяют вещества, обладающие окислительными и (или) восстановительными свойствами.
Окислительно-восстановительные процессы могут протекать самопроизвольно в природных водных системах или использоваться для очистки вторичных промышленных вод.
Наиболее целесообразно этот метод применять в том случае, когда в результате осуществления реакции происходит разрушение примесей с образованием нетоксичных или малотоксичных веществ.
Метод окисления используется для обезвреживания сточных вод, содержащих токсичные примеси, а также для извлечения из сточных вод веществ, которые нельзя или нецелесообразно извлекать другими способами.
Напомним, что реакции, в результате которых изменяются степени окисленности элементов, называют окислительно-восстановительными.

Отдача электрона, сопровождающаяся повышением степени окисленности элемента, называется окислением. Присоединение электронов, сопровождающееся понижением степени окисленности элемента, называется восстановлением.
Вещество, в состав которого входит окисляющийся элемент, называется восстановителем, вещество, содержащее восстанавливающийся элемент, — окислителем.
Число электронов, отдаваемых молекулами восстановителя, равно числу электронов, присоединяемых молекулами окислителя.
Любую окислительно-восстановительную реакцию можно представить в виде двух полуреакций — окисления и восстановления.
Пример. Рассмотрим окислительно-восстановительную реакцию:
2НС1 + Fe FeCl2 + H2
Эту реакцию можно представить в виде двух полуреакций:
• реакция окисления:
Fe — 2е Fe2+
• реакция восстановления:
2Н+ + 2е Н2
Окислительно-восстановительные реакции имеют большое значение в природных биологических системах. Фотосинтез и биогенез протекают при осуществлении окислительно-восстановительных реакций. В природных водных источниках в реакциях такого типа участвуют биологические организмы.
Существует электрохимический ряд элементов, который отражает относительную реакционную способность элементов к окислению и восстановлению. По термодинамическим и физико-химическим параметрам на основе окислительно-восстановительного потенциала (ОВП) и значения рН можно предсказать, какие вещества в воде могут окисляться, какие — восстанавливаться.
В качестве окислителей в промышленности при очистке воды используют кислород воздуха, хлор и его соединения, озон, перекись водорода, перманганат калия.
Окислительно-восстановительный потенциал некоторых окислителей
Вещество Реакция № реакции ОВП
при 25 «С, В
Озон 03 + 2Н+ + 2е —> 02 + Н20
Перекись водорода в кислой среде Н202 + 2Н+ + 2е —> 2Н20
Перманганат Мп04 + 8Н+ +5е Мп2++ 4Н20
Хлорноватистая кислота НС10 + Н+ +2е CI» + Н20
Хлор С12 +2е 2С1-
Оксид хлора(1У) С102 + е СЮ2
Бром Вг2 +2е 2Вг
Гипохлорит СЮ» + Н20 + 2е С1~ + 20Н~
Перекись водорода в щелочной среде Н202 + 2е—> 20Н~
Кислород 02 + 2Н20 + 4е —> 40Н~
Кислород из всех представленных окислителей имеет наименьшее значение потенциала, и, следовательно, обладает наименьшей окислительной способностью. Его используют при проведении процессов термоокисления. С помощью кислорода окисляют Fe2+, если концентрация железа в растворе достаточно высокая.
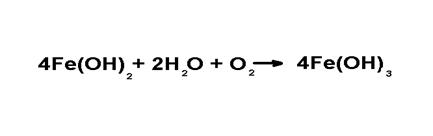
Кислород воздуха применяют для окисления органических веществ в растворах только в сочетании с биологическими компонентами, например в процессах ферментативного окисления — активным илом.
Озон является самым сильным окислителем из всех веществ, представленных в таблице. Озонирование применяется для очистки сточных вод от фенолов, нефтепродуктов, сероводорода, мышьяка, ПАВ, цианидов, ароматических углеводородов, пестицидов, а также для обеззараживания питьевой воды. Для окисления озоновоздушную смесь вводят в воду, в которой озон диссоциирует. В слабощелочной среде 03 диссоциирует очень быстро, в кислотной среде проявляет большую стойкость. Озон получают в генераторах из кислорода воздуха под действием электрического разряда. Озон является дезинфицирующим веществом, его используют для нормализации микробиологического состава воды. Преимуществом применения озона является и тот факт, что после осуществления реакции с использованием Оэ образуется кислород, и вода не загрязняется побочными веществами. Широкое применение озона сдерживает его высокая стоимость.
Перекись водорода является сильным и чистым окислителем. При его распаде в воде не образуется побочных веществ. Следует учитывать различную окислительную способность этого вещества в зависимости от рН среды.
Перманганат используют в виде его соли перманганата калия. Это широко известный окислитель, обладающий высокой окислительной способностью, которая проявляется только в кислой или нейтральной среде. В щелочных средах перманганат калия окислительных свойств не проявляет.
Хлор является сильным окислителем. Различные соединения хлора могут быть использованы в качестве окислителей. Это хлор С12), хлорноватистая кислота НСЮ, соли хлорноватистой кислоты — гипохлорит натрия NaCIO или гипохлорит кальция Са(СЮ)2 и оксид хлора СЮ2.
Хлорирование применяют для удаления из сточных вод фенолов, крезолов, цианидов, сероводорода. Для борьбы с биологическими обрастаниями сооружений его используют в качестве биоцида. Применяют хлор и для обеззараживания воды.
Хлор поступает на производство в жидком виде с содержанием не менее 99,5 %. Хлор является высокотоксичным газом, он обладает способностью накапливаться и концентрироваться в небольших углублениях. С ним достаточно трудно работать. При попадании в воду происходит гидролиз хлора с образованием соляной кислоты. С некоторыми органическими веществами, которые присутствуют в растворе, С12 может вступать в реакции хлорирования. В результате образуются вторичные хлорорганические продукты, которые обладают высокой степенью токсичности. Поэтому применение хлора стремятся ограничить.
Хлорноватистая кислота НСЮ обладает такой же окислительной способностью, как и хлор. Однако ее окислительные свойства проявляются только в кислой среде. Кроме того хлорноватистая кислота является нестабильным продуктом — со временем и на свету она разлагается.
Широкое применение получили соли хлорноватистой кислоты. Гипохлорит кальция Са(СЮ)2 выпускается трех сортов с концентрацией активного хлора от 32 до 35 %. На практике используют также двухосновную соль Са(СЮ)2- 2Са(ОН)г 2Н20.
Наиболее устойчива соль гипохлорита натрия NaOCl * 5Н20, которую получают при химическом взаимодействии газообразного хлора с раствором щелочи или при электролизе поваренной соли в ванне без диафрагмы.
Оксид хлораСO2 — газ зеленовато-желтого цвета, хорошо растворим в воде, сильный окислитель. Его получают взаимодействием хлорита NaC102 с хлором, соляной кислотой или озоном. При взаимодействии оксида хлора с водой не ротекают реакции хлорирования, что исключает образование хлорорганических веществ. В последнее время проводятся широкие разработки по выяснению условий замены хлора на оксид хлора в качестве окислителя. На ряде российских заводов внедрены передовые технологии с использованием СO2.
Бром Вг2 также может быть использован в качестве окислителя. В ряде зарубежных работ его рассматривают как альтернативную замену хлора. В России в настоящее время подобные работы не проводятся.
В промышленности используется ряд процессов при очистке воды с применением окислителей. Рассмотрим некоторые из них.
Удаление железа. Железо может присутствовать в воде в коллоидном состоянии, в виде двухвалентных ионов или комплексного (хелатного) соединения. Для удаления железа, входящего в комплекс с органическими веществами, нужно окислить органическое вещество с последующим выделением железа путем осаждения.
Рассмотрим реакцию
Fe3+ + е — Fe2+
константа равновесия которой равна:
К = [Ff2+] = 3,4 * 1013
[Fe3+ ]fe]
Используя эти параметры, получим уровень активности электронов (рЕ° 12,53), при которой концентрации двух- и трехвалентного железа в среде, не содержащей кислород, будут одинаковыми.
В окружающей среде при воздействии кислорода рЕ возрастает до 16,49, при этом концентрация ионов двухвалентного железа снижается примерно до 10~4 от общей концентрации железа в растворе. На этом явлении основан процесс очистки воды от ионов железа при обработке растворов окислителями.
 При концентрации железа более 5 мг/л в качестве окислителя используют O2. Воду перед подачей на осветлитель подвергают аэрации (насыщают воздухом) и выдерживают в емкости 60 — 90 мин. За это время образуется трехвалентное железо, которое выпадает в осадок.
При концентрации железа более 5 мг/л в качестве окислителя используют O2. Воду перед подачей на осветлитель подвергают аэрации (насыщают воздухом) и выдерживают в емкости 60 — 90 мин. За это время образуется трехвалентное железо, которое выпадает в осадок.
Если концентрация железа в растворе менее 5 мг/л, то для осаждения железа нужен более сильный окислитель. Чаще всего для этого используют хлор, а рН среды увеличивают до 8,5. Протекает реакция: 2Fe2+ + Cl2 — 2Fe3+ + 2СГ
При этом на 1 мг Fe для окисления требуется 0,64 мг С12.
Хлорирование воды.
Для обеззараживания воды и окисления токсичных примесей питьевую воду обрабатывают хлором, который помимо образования продуктов окисления может участвовать в реакциях замещения, в частности с фенолом. При этом возможно образование хлороформа и других хлорорганических соединений, многие из которых обладают высокотоксичными и мутагенными свойствами. Поэтому в странах Европы и США уже в течение многих лет для дезинфекции воды в системах хозяйственно-бытового водоснабжения используют озон.
Очистка циансодержащих сточных вод. Циансодержащие примеси могут быть окислены с помощью хлора до элементарных нетоксичных соединений азота и углерода. Процесс протекает в несколько стадий.
Одной из разновидностей окислительных процессов является термоокисление, при проведении которого при высокой температуре первоначально происходит испарение избыточной влаги из раствора, а затем окисление (сгорание) примесей. Этот метод отличается большим расходом энергии и высокой стоимостью.
Восстановительные реакции используются при обработке промышленных вод, содержащих растворенные кислород, хлор или хроматы. В качестве восстановителей чаще всего применяют оксид серы и сульфиты.
Далее приведены реакции, типичные для каждого из этих процессов.
Удаление из растворов кислорода:
CN + С12 + Н20 — 2НС1 + CNO
02 + 2S032 — 2S042
Сильными восстановительными свойствами обладает боргидрид лития. Он применяется для восстановления в сточных водах металлорганических соединений. Его используют, например, для удаления тетраэтилсвинца, который восстанавливается до металлического свинца с последующим удалением его из раствора фильтрацией.
Эффективным восстановителем является водород. Он применяется на атомных электростанциях, где нельзя использовать другие восстановители, а также для дезактивации кислорода, образующегося в процессе распада воды при бомбардировке нейтронами.
Почва


Почва представляет собой совершенно особое природное образование, обладающее только ей присущим строением, составом и свойствами. Гранулометри́ческийсоста́в (механический состав, почвенная текстура) — относительное содержание в почве, горной породе или искусственной смеси частиц различных размеров независимо от их химического или минералогического состава. Гранулометрический состав является важным физическим параметром, от которого зависят многие аспекты существования и функционирования почвы, в том числе плодородие.
В почвах и породах могут находиться частицы диаметром как менее 0,001 мм, так и более нескольких сантиметров. Для подробного анализа весь возможный диапазон размеров делят на участки, называемые фракциями. Единой классификации частиц не существует. Исторически первая классификация фракций предложена А. Аттербергом в 1912. Шкала Аттерберга легла в основу более новых зарубежных классификаций. В СССР и России была принята несколько иная классификация Н. А. Качинского.

Классификации почв по гранулометрическому составу
В настоящее время получили распространение два основных принципа построения классификаций:
На основании содержания физической глины с учётом доминирующей фракции и типа почвообразования. Разработана Н.А. Качинским и принята в России и в некоторых других странах.
На основании относительного содержания фракций песка, пыли и глины по Аттербергу. Международная классификация, классификации общества почвоведов (SSSA) и общества агрономов (ASSA) США. Для определения названия почвы используют треугольник Ферре.
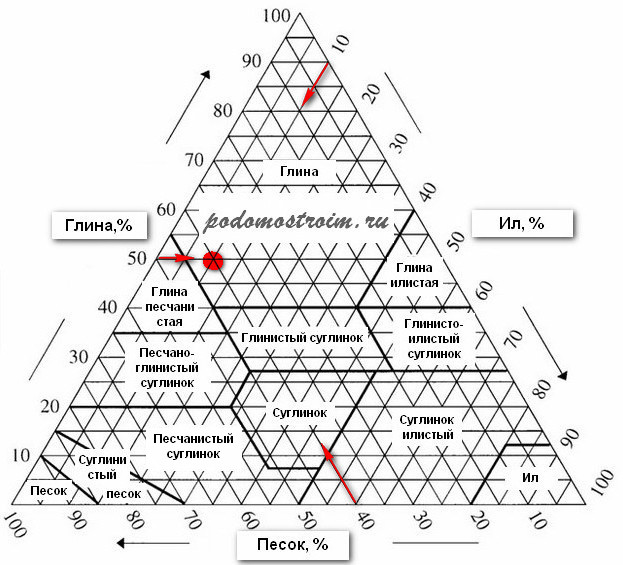
Однозначного перехода от одной классификации к другой не существует, однако используя кумулятивную кривую выражения результатов гранулометрического состава можно назвать почву по обеим классификациям.

Влияние гранулометрического состава на свойства почв и пород
Гранулометрический состав определяет многие физические свойства и водно-воздушный режим почв, а также химические, физико-химические и биологические свойства. Тяжёлые почвы могут иметь проблемы с воздухосодержанием, лёгкие — с водным режимом.

Разные фракции обычно представлены различными минералами. Так, в крупных преобладает кварц, в мелких — каолинит.(Каолинит — глинистый минерал из группы водных силикатов алюминия)
Методы определения (гранулометрия)
Методы определения гранулометрического состава грунтов можно разделить на прямые и косвенные. К прямым относятся методы, основанные на непосредственном (микрометрическом) измерении частиц в поле зрения оптических и электронных микроскопов или с помощью других электронных и электронно-механических устройств. В практике прямые (микрометрические) методы не получили широкого распространения. К косвенным относятся методы, которые базируются на использовании различных зависимостей между размерами частиц, скоростью осаждения их в жидкой и воздушной средах и свойствами суспензии. Это группа методов, основанных на использовании физических свойств суспензии (ареометрический, оптический и др.)
Ареометрический метод основан на последовательном определении плотности суспензии грунта через определенные промежутки времени с помощью ареометра.
 По результатам определений рассчитывают диаметр и количество определяемых частиц по формуле или с помощью номограммы. Этим методом определяют содержание в грунте частиц диаметром менее 0,1 мм. Содержание фракций крупнее 0,1 мм определяют ситовым методом. Устройство ареометра (рис. 1) основано на законе Архимеда: всякое погруженное в жидкость тело теряет в своем весе столько, сколько весит вытесненная им жидкость. При постоянном объеме тела, погруженного в жидкость, более тяжелой жидкости будет вытеснено меньше, а более легкой – больше. Таким образом в легкую жидкость тело будет погружено на большую глубину, в тяжелую на меньшую. Следовательно, чем больше концентрация суспензии, тем больше ее плотность и меньше глубина, на которую погружается в нее ареометр. При отстаивании суспензии частицы грунта, подчиняясь закону силы тяжести, падают на дно сосуда, и плотность суспензии уменьшается. Соответственно ареометр по мере выпадения частиц постепенно погружается в суспензию глубже и глубже.
По результатам определений рассчитывают диаметр и количество определяемых частиц по формуле или с помощью номограммы. Этим методом определяют содержание в грунте частиц диаметром менее 0,1 мм. Содержание фракций крупнее 0,1 мм определяют ситовым методом. Устройство ареометра (рис. 1) основано на законе Архимеда: всякое погруженное в жидкость тело теряет в своем весе столько, сколько весит вытесненная им жидкость. При постоянном объеме тела, погруженного в жидкость, более тяжелой жидкости будет вытеснено меньше, а более легкой – больше. Таким образом в легкую жидкость тело будет погружено на большую глубину, в тяжелую на меньшую. Следовательно, чем больше концентрация суспензии, тем больше ее плотность и меньше глубина, на которую погружается в нее ареометр. При отстаивании суспензии частицы грунта, подчиняясь закону силы тяжести, падают на дно сосуда, и плотность суспензии уменьшается. Соответственно ареометр по мере выпадения частиц постепенно погружается в суспензию глубже и глубже.
К косвенным методам также относится и полевой метод Рутковского, который дает приближенное представление о гранулометрическом составе грунтов. В основу метода положены:
1) различная скорость падения частиц в воде в зависимости от их размера;
2) способность глинистых частиц набухать в воде.
С помощью метода Рутковского выделяют три основные фракции: глинистую, песчаную и пылеватую. В полевых условиях на практике этот метод целесообразно применять для определения песков пылеватых и супесей.
В особую группу выделяют методы определения размеров частиц с помощью ситовых наборов. Они занимают промежуточное положение между прямыми и косвенными методами и широко используются в практике самостоятельно или в комбинации с другими методами.
Гранулометрический состав грунтов является определяющим фактором для физико-механических свойств грунтов. От него зависят пластичность, пористость, водопроницаемость, сжимаемость, сопротивление сдвигу грунтов и др.
Согласно действующему ГОСТу по гранулометрическому составу классифицируются крупнообломочные и песчаные грунты

СОДЕРЖАНИЕ АЗОТА В ПОЧВАХ.
Азот– один из самых необходимых для растений химический элемент. Присутствует повсеместно в свободном или связанном состоянии. Азотные удобрения выпускаются в различных формах и применяются для основного и предпосевного внесения – как поверхностного, так и наподкормку. Только 1 % азота почвы находится в легко усваиваемых растениями минеральных формах, поэтому применение азотных удобрений – важное условие для сохранения и повышения плодородности сельскохозяйственных земель.
Физические и химические свойства
Азот – химический элемент V группы системы Менделеева. Атомный номер – 7, атомная масса – 14,0067. Природный азот составлен из двух стабильных изотопов.[6]
Азот – бесцветный газ, не имеющий запаха.
В воде малорастворим, легче воздуха. Молекулярный азот химически малоактивен. При комнатной температуре взаимодействует только с литием. При нагревании реагирует с кальцием, магнием, титаном. Реакция взаимодействия с водородом проходит под воздействием высоких температур, высокого давления и в присутствии катализатора, с кислородом – при температуре 3000–4000°С.
Наибольшее значение из соединений с водородом имеет аммиак – газ без цвета с характерным запахом нашатырного спирта.
С кислородом азот образует ряд оксидов: закись азота N2O, окись азота NO, диоксид азота NO2, азотистый ангидрид N2O3.
Содержание азота в различных типах почв
На долю органических соединений – белков, аминов, амидов, аминокислот и прочих – приходится 93–95 % почвенного азота. Однако органический азот практически недоступен растениям и становится усваиваемым ими только после минерализации.
Минеральный азот, входящий в состав нитратных и аммиачных форм, накапливается в почве в результате процессов аммонификации и нитрификации, которые осуществляют различные группы микроорганизмов.
Разложение азотистых органических соединений в различных типах почв проходит по единой схеме:
белки → гуминовые вещества → аминокислоты → амиды → аммиак → нитриты → нитраты
Скорость минерализации основного запасного фонда азота – органических веществ почвы – зависит от многих факторов: влажности почвы, температурного режима, кислотности, характера органического вещества. Поэтому количество образующихся минеральных форм азота постоянно пребывает в динамичном состоянии. Максимальное количество накапливается в весенний период, наиболее благоприятный по режиму температуры и влажности для нитрификации. Однако нитраты – подвижные соединения, и они могут вымываться из почвы или подвергаться биологической денитрификации (образованию газообразных форм). В результате почва теряет часть азота.
Валовое содержание азота в почве сильно варьирует и зависит от типа почвы, гранулометрического состава, запасов органики, режима увлажнения и степени окультуренности почвы.
Содержание общего азота тем больше, чем больше содержание гумуса. Кроме того, содержание доступного элемента значительно возрастает при окультуривании почвы.
Дерново-подзолистые почвы
содержат 0,1–0,16 % азота. Количество минеральных соединений (обменно-поглощенного аммония и нитратов) мало – оно не превышает 1–3 % общего содержания данного элемента.
Содержание и запасы азота в метровом слое данных почв суглинистого состава в 2–2,5 раза больше, чем в песчаных. Кроме того, содержание азота снижается в нижележащих горизонтах.
| Содержание и запасы азота в дерново-подзолистых почвах, согласно данным:[2] | |||||
| Глубина взятия образца, см | Гумус, % | Общий азот, % | Запасы общего азота, т/га | Фиксированный аммоний мг/кг % от общ. N | |
| Среднесуглинистая почва на моренном суглинке | |||||
| 4 - 20 | 2,45 | 0,179 | 6,4 | 51,2 | 2,9 |
| 30 - 40 | 0,69 | 0,064 | 1,4 | 41,4 | 6,5 |
| 55 - 68 | 0,32 | 0,054 | 2,8 | 44,0 | 8,2 |
| 90 - 100 | 0,20 | 0,031 | 3,5 | 33,8 | 10,9 |
| 165 - 175 | 0,07 | 0,025 | 2,3 | 40,4 | 16,2 |
| Легкосуглинистая на лессовидном суглинке | |||||
| 2 - 18 | 1,69 | 0,119 | 3,1 | 46,0 | 3,9 |
| 30 - 40 | 0,81 | 0,091 | 3,7 | 42,5 | 4,7 |
| 55 - 65 | 0,51 | 0,056 | 3,8 | 44,0 | 7,9 |
| 102 - 114 | 0,28 | 0,320 | 1,7 | 37,3 | 11,7 |
| 140 - 150 | 0,22 | 0,036 | 4,7 | 43,0 | 11,9 |
| Связнопесчаная, подстилаемая моренным суглинком | |||||
| 5 - 15 | 1,30 | 0,070 | 2,2 | 14,5 | 2,1 |
| 25 - 35 | 0,48 | 0,039 | 1,2 | 11,8 | 3,0 |
| 50 - 65 | 0,14 | 0,014 | 0,6 | 1,7 | 1,2 |
| 80 - 100 | 0,14 | 0,021 | 1,6 | 18,4 | 8,8 |
| 140 - 150 | 0,07 | 0,013 | 1,1 | 24,5 | 18,9 |
Дерново-подзолистые избыточно увлажняемые почвы
отличаются повышенным содержанием азота. С увеличением гидроморфности его содержание возрастает. Запасы валовых форм азота в метровом слое временно избыточно увлажняемых почв больше, чем в аморфных: в суглинистых – на 27 %, супесчаных – на 14 %, песчаных – на 11 %. Характерно, что с возрастанием степени гидроморфности почв доля минерального азота снижается, а трудногидролизуемого и легкогидролизуемого – возрастает.[1]
Чернозем
. Общий запас азота в пахотном слое может достигать до 15 тонн на гектар.[2]
Торфяно-болотные почвы
наиболее богаты по содержанию азота – 2,5–5,2 %. Например, в пахотном горизонте (0–25 см) торфяно-болотных почв Беларуси содержание общего азота составляет 16–20 т/га, в верхнем горизонте может накапливаться до 300–500 кг/га минерального азота. Мелиорация торфяно-болотных почв способствует активизации процессов минерализации азота и уплотнения торфа.[1]

Азотофиксирующие клубеньки бобовых
Биохимические функции
Химические соединения – источники азота
Соли азотной кислоты и аммония
– основной источник азота для растений. Кроме того, растения способны усваивать и некоторые из растворимых в воде органических соединений азота: аминокислоты, мочевину, аспарагин.
В тканях растения азотистые соединения подвергаются сложным превращениям, результатом которых становиться образование аминокислот, а затем белков.
Аммиак
– единственное соединение азота, поглощаемое из почвы, которое непосредственно используется для синтеза аминокислот. Аммиак в свободном виде может содержаться в тканях растений, но в незначительном количестве.
Значительное накопление аммиака при недостатке углеводов (источника кетокислот), приводит к аммиачному отравлению растений. Однако растения обладают способностью связывать избыток свободного аммиака. Большая его часть вступает во взаимодействие с ранее синтезированными аспарагиновой и глутаминовой аминокислотами с образованием амидов – аспарагина и глутамина (играют важную роль в синтезе белков). Этот процесс позволяет растениям не только защититься от аммиачного отравления, но и создавать резерв аммиака, который будет использоваться в дальнейшем по мере необходимости.
Нитраты и нитриты
– вовлекаются в синтез аминокислот только после восстановления в тканях растения. Редукция нитратов до аммиака проходит уже в корнях. Этот процесс осуществляется с помощью флавиновыхметаллоферментов, с сопровождением изменения валентности атомов азота. При поступлении нитратного азота в растения в избытке часть его в неизменном состоянии доходит до листьев, где происходит восстановление нитратов.
Нитратный азот растения могут накапливать в значительных количествах, без особого вреда для собственной жизнедеятельности.
Биосинтез аминокислот (аминирование)
Аминирование
(биосинтез аминокислот) осуществляется в результате взаимодействия аммиака с кетокислотами (пировиноградной, щавеллевоуксусной, кетоглуаровой и др.). Данные кислоты образуются в процессе дыхания при окислении углеводородов. Аминирование проходит с помощью ферментов.
В аминокислотах азот присутствует в виде аминогруппы – NH2. Образование аминокислот может происходить как в подземной (корнях), так и в наземных частях растений.
Установлено, что уже через несколько минут после подкормки растений аммиачными удобрениями в их тканях обнаруживаются аминокислоты, синтезированные с использованием внесенного в подкормку аммиака. Первой аминокислотой, образующейся в растении, является аланин, затем синтезируются аспарагиновая и глутаминовая кислоты.
Переаминирование аминокислот
Реакция переаминирования аминокислот заключается в переносе аминогруппы с аминокислоты на кетокислоту. При этом образуются другие амино- и кетокислоты. Эта реакция катализируется ферментами аминоферазами и трансаминазами.
Путем переаминирования синтезируется значительное число аминокислот. Наиболее легко в этот процесс вовлекаются глутаминовая и аспарагиновая кислоты.
Разнообразие белковых и небелковых азотистых соединений
Как указывалось ранее, аминокислоты представляют собой основные структурные единицы белков и полипептидов, поскольку белки образуются из синтезированных в полипептидные цепи аминокислот. Различный набор и пространственное расположение аминокислот в полипептидных цепях способствуют синтезу огромного разнообразия белков. Известно свыше 90 аминокислот. Значительная их часть (около 70) присутствует в растительных тканях в свободном состоянии и не входит в состав белковых молекул.
В состав белков растений входят незаменимые для жизнедеятельности человека и животных белки: лизин, фенилаланин, триптофан, валин, треонин, метионин и другие. В организме млекопитающих и других высших животных данные белки синтезироваться не могут.
Растения содержат 20 – 26% небелкового органического азота от общего количества. В неблагоприятных условиях (дефицит калия, недостаток освещенности) количество небелковых азотистых соединений в растениях повышается.
Дезаминирование аминокислот
Белки и небелковые азотистые соединения находятся в тканях растений в подвижном равновесии. Наряду с синтезом аминокислот и белковых соединений, постоянно проходят процессы их распада.
Реакция дезаминирования
заключается в отщеплении аминогруппы от аминокислоты с образованием кетокислоты и аммиака. Освободившаяся кетокислота идет на биосинтез углеводов, жиров и прочих веществ. Аммиак вступает в реакцию аминирования других кетокислот, образуя соответствующие аминокислоты. При избытке аммиака образуются аспарагин и глутамин.
Весь сложнейший цикл трансформации и превращения азотистых соединений в растении начинается с аммиака и завершается аммиаком.
Обмен азотистых веществ в различные периоды развития растения
За время роста растения синтезируют большое количество разнообразных белков, и в разные периоды роста процесс обмена азотистых веществ протекает по-разному.
При прорастании семенного материала наблюдается распад ранее запасенных белков. Продукты распада идут на синтез аминокислот, амидов и белков в тканях проростков до выхода их на поверхность почвы.
По мере образования листового аппарата и корневой системы синтез белков проходит за счет минерального азота, поглощенного из почвы.
В органах молодых растений преобладает синтез белков. В процессе старения распад белковых веществ начинает преобладать над синтезом. Из стареющих органов продукты распада движутся в молодые, интенсивно растущие, где и находят применение для синтеза белка в точках роста.
При созревании и формировании репродуктивных органов растения происходит распад веществ в вегетативных частях растений и передвижение их в репродуктивные органы, где они используются в процессах синтеза запасных белков. В это время потребление азота из почвы значительно ограничивается или совсем прекращается.
Недостаток (дефицит) азота в растениях
Азот плохо усваивается растениями при холодной погоде, на кислых неизвесткованных почвах, на почвах, содержащих большое количество небобовых культур и опилок.
Первый признак азотного голодания – изменение окраски листовой пластинки с зеленой на бледно-зеленую, а затем желтоватую и бурую из-за недостаточного образования хлорофилла.
При дальнейшем усилении дефицита азота размер листьев уменьшается. Они становятся узкими, мелкими, располагаются под острым углом к стеблю или ветви. Ветвление у растений ослабляется, уменьшается число плодов, зерен или семян.

Дата добавления: 2015-08-17; просмотров: 593 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Озон и климат. | | | Избыток азота |