
Читайте также:
|
Каталитические процессы, обусловленные переносом электрона (окисление, восстановление, гидрирование, дегидрирование, разложение нестойких кислородсодержащих соединений), относят к окислительно-восстановительному катализу. Типичными катализаторами для них являются переходные металлы и их соединения: простые оксиды 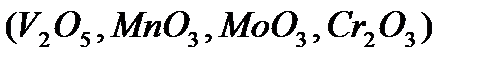 , шпинели
, шпинели 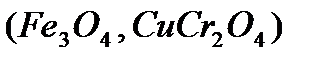 , сульфиды
, сульфиды  и др.; для реакций в растворах - соли и комплексные соединения переходных металлов. Высокая каталитическая активность этих веществ объясняется тем, что атомы переходных металлов могут существовать в различных степенях окисления, изменение которых не требует больших энергетических затрат. В результате перенос электрона от реагента к катализатору осуществляется легче, чем в отсутствие катализатора от восстановителя к окислителю. При одноэлектронном переходе образуются свободные радикалы, далее участвующие в реакции. Напр., при переходе одного электрона от активного центра молибденового катализатора к кислороду образуется ион-радикал
и др.; для реакций в растворах - соли и комплексные соединения переходных металлов. Высокая каталитическая активность этих веществ объясняется тем, что атомы переходных металлов могут существовать в различных степенях окисления, изменение которых не требует больших энергетических затрат. В результате перенос электрона от реагента к катализатору осуществляется легче, чем в отсутствие катализатора от восстановителя к окислителю. При одноэлектронном переходе образуются свободные радикалы, далее участвующие в реакции. Напр., при переходе одного электрона от активного центра молибденового катализатора к кислороду образуется ион-радикал  , участвующий далее в каталитическом окислении
, участвующий далее в каталитическом окислении 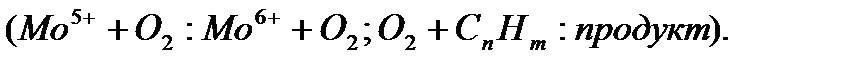 Существует окислительно-восстановительные катализаторы с многоэлектронным механизмом, при котором не образуются свободные радикалы в качестве промежуточных частиц. Многоэлектронные переходы между катализатором и реагирующими молекулами возможны, если в активный центр катализатора входят несколько атомов переходного металла. Например, в разложении
Существует окислительно-восстановительные катализаторы с многоэлектронным механизмом, при котором не образуются свободные радикалы в качестве промежуточных частиц. Многоэлектронные переходы между катализатором и реагирующими молекулами возможны, если в активный центр катализатора входят несколько атомов переходного металла. Например, в разложении 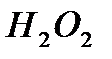 активны комплексные соединения, содержащие 2 иона
активны комплексные соединения, содержащие 2 иона 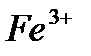 ; в восстановлении молекулы азота до
; в восстановлении молекулы азота до 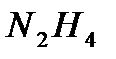 - комплексные соединения, содержащие 2 или более ионов
- комплексные соединения, содержащие 2 или более ионов 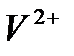 .
.
К процессам кислотно-основного катализа относятся каталитический крекинг, гидратация, дегидратация, многие реакции изомеризации, конденсации органических веществ. Типичные катализаторы для этого класса процессов – вещества, способные передавать или принимать протон от реагентов или же способные к гетеролитическому взаимодействию с реагентами (без разделения пары электронов). Среди этих веществ –протонные 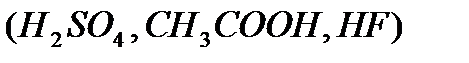 и апротонные
и апротонные 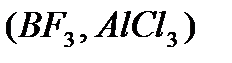 кислоты, аморфные и кристаллические алюмосиликаты,
кислоты, аморфные и кристаллические алюмосиликаты, 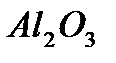 , фосфаты, сульфаты. Активными центрами в них является протонный центр
, фосфаты, сульфаты. Активными центрами в них является протонный центр 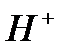 (центр Бренстеда) или акцептор электронной пары, например, атом
(центр Бренстеда) или акцептор электронной пары, например, атом 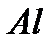 (центр Льюиса). Реже применяются катализаторы основного характера (растворенные основания, твердые
(центр Льюиса). Реже применяются катализаторы основного характера (растворенные основания, твердые 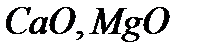 и др.). В случае, так называемых полифункциональных катализаторов, отдельные этапы сложных каталитических процессов окислительно-восстановительные и кислотно-основные – протекают на разных составных частях многокомпонентной многофазной системы. Например, при неполном окислении непредельных альдегидов в непредельные кислоты в присутствии оксидов
и др.). В случае, так называемых полифункциональных катализаторов, отдельные этапы сложных каталитических процессов окислительно-восстановительные и кислотно-основные – протекают на разных составных частях многокомпонентной многофазной системы. Например, при неполном окислении непредельных альдегидов в непредельные кислоты в присутствии оксидов 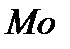 и
и 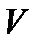 в элементарном акте происходят окислительно-восстановительные превращения катализатора:
в элементарном акте происходят окислительно-восстановительные превращения катализатора:

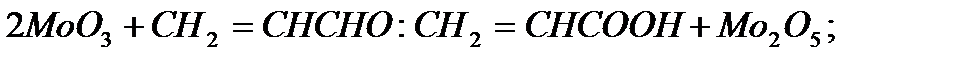
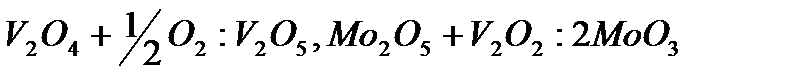
Конечная стадия реакций - десорбция кислоты - происходит на поверхностях 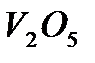 и
и 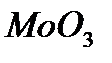 ,обладающих слабокислотными свойствами. В водных растворах каталитическая активность солей или комплексных соединений переходных металлов проявляется в определенном интервале рН. Это объясняется не только устойчивостью комплексных соединений при определенном рН, но и участием ионов
,обладающих слабокислотными свойствами. В водных растворах каталитическая активность солей или комплексных соединений переходных металлов проявляется в определенном интервале рН. Это объясняется не только устойчивостью комплексных соединений при определенном рН, но и участием ионов 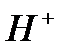 и
и 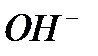 в элементарных стадиях Катализа [5].
в элементарных стадиях Катализа [5].
Дата добавления: 2015-08-17; просмотров: 97 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Гомогенно- и гетерогенно-каталитические процессы | | | Глава 3. Активность и приготовление катализаторов |