
Читайте также:
|
Гомогенно-каталитические процессы в газовой фазе встречаются редко, т. к. газообразные катализаторы почти неизвестны. Примером может служить процесс пиролиза ацетальдегида, катализируемый парообразным иодом:
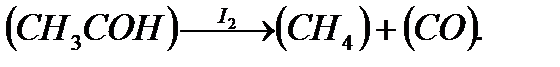
В этом процессе катализатор снижает энергию активации с 198 до
134 кДж/моль.
Гомогенный катализ наиболее распространен в растворах. В связи с большим числом конкретных примеров гомогенно-каталитические реакции этого типа принято делить на кислотно-основные и окислительно-восстановительные с участием комплексных соединений. К кислотно-основном катализу относят процессы изомеризации, гидратации и дегидратации, гидролиза, этерификации, алкилирования, деполяризации. В зависимости от типа основания или кислоты эти реакции условно делят на четыре группы:
1) cпецифический кислотный катализ ионами  ;
;
2) cпецифический основной катализ ионами  ;
;
3) общий кислотный катализ (любыми кислотами);
4) общий основной катализ (любыми основаниями);
Если процесс, катализируемый кислотой или основанием, идет в растворе, то общая скорость реакции будет равна сумме скоростей реакций, катализируемых соответствующими катализаторами.
Перейдем к рассмотрению гомогенного катализа комплексными соединениями переходных металлов. При таком катализе в присутствии комплексных катализаторов (чаще всего катионов переходных металлов) осуществляют реакции восстановления и окисления, гидрирования и гидратации, полимеризации и изомеризации. Примером может служить метод промышленного окисления этилена до ацетальдегида в водной среде в присутствии палладиевого катализатора:

Окисление образующегося металлического палладия осуществляется ионом  :
:
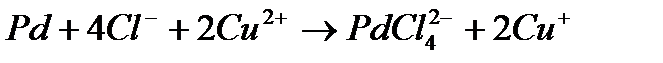
и, наконец, 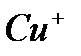 окисляется кислородом воздуха до
окисляется кислородом воздуха до  :
:
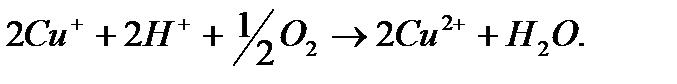
Этот процесс в промышленных условиях идет сначала без доступа воздуха, образовавшийся ацетальдегид отгоняют, после чего введут продувку воздуха. Если в этом процессе заменить хлор на бром, скорость реакции возрастет в 17 раз; если вести процесс в уксуснокислой среде, из этилена образуется винилацетат. Приведенный пример показывает, что, воздействуя на катализатор, можно изменить не только скорость, но и химическую схему каталитической реакции.
Остановимся на характеристике гомогенно-каталитического ферментативного катализа, который осуществляется при использовании биологических катализаторов – ферментов, представляющих собой природные белки, входящие в состав тканей. Ферментативный катализ является основой управления сложных жизненных процессов в растениях и животных организмах. Так, фотосинтез, брожение, дыхание, пищеварение, синтез белков, сокращение мышц являются каталитическими процессами, использующими в качестве катализаторов различные ферменты.
Среди других видов каталитических реакций ферментативный катализ является самым высокоорганизованным, поскольку ферменты отличаются высокой избирательностью, специфичностью и каталитической активностью. Ферменты – это высокомолекулярные белки, состоящие из различных аминокислот, связанных пептидными связями. Нативная конформация молекулы фермента образует активный каталитический центр, содержащий полярные 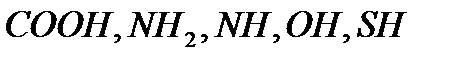 , а также гидрофобные группы, способные ориентировать молекулы реагирующих веществ в определенном положении по отношению к активном центру. В состав активного центра многих ферментов входят ионы металлов, причем при удалении иона металла из металлофермента последний теряет каталитические свойства. Активные центры ферментов имеют строго определенную структуру, что позволяет им присоединять только молекулы определенного строения. В настоящее время известно около тысячи ферментов, один из которых катализируют только окислительно-восстановительные процессы, другие – реакции с переносом групп, третьи – реакции гидролиза и др.
, а также гидрофобные группы, способные ориентировать молекулы реагирующих веществ в определенном положении по отношению к активном центру. В состав активного центра многих ферментов входят ионы металлов, причем при удалении иона металла из металлофермента последний теряет каталитические свойства. Активные центры ферментов имеют строго определенную структуру, что позволяет им присоединять только молекулы определенного строения. В настоящее время известно около тысячи ферментов, один из которых катализируют только окислительно-восстановительные процессы, другие – реакции с переносом групп, третьи – реакции гидролиза и др.
Если говорить об гетеро-каталитических процессах, то они занимают особое место в кинетике и протекают на границе раздела фаз твердое тело – газ, твердое тело – жидкость. Эти процессы широко используют в промышленной практике. В табл. 1(стр.8) приведены примеры таких каталитических процессов и катализаторов.
Преимущество гетерогенно-каталитических процессов перед гомогенном катализе объясняется большим удобством гетерогенных катализаторов, легкостью их отделения от реагирующих веществ. Важнейшая характеристика гетерогенного катализатора – величина его активной поверхности. Часто катализаторы получают нанесением активной формы на пористый носитель (трегер) с высокоразвитой поверхностью. В качестве таких носителей применяют активированный голь, силикагель, оксид хрома (III) и др. Многие катализаторы получают осаждением из растворов в виде гидроксидов ( и др.) с последующей термической обработкой. Повышение температуры обычно приводит к увеличению скорости гетерогенно-каталитического процесса. Гетерогенный катализ более сложен в плане теоретического описания, чем гомогенный. Если в гомогенном катализе катализатор находится в молекулярном состоянии, которое можно строго описать термодинамически, то в гетерогенном катализе, как правило, неясно, что принимать за молекулярную единицу катализатора и как охарактеризовать состояние молекул, находящихся на границе с твердой фазой катализатора. Поэтом для физико-химических описания различных стадий гетерогенно-каталитического процесса часто прибегают к условным понятиям и приближенным моделям.
и др.) с последующей термической обработкой. Повышение температуры обычно приводит к увеличению скорости гетерогенно-каталитического процесса. Гетерогенный катализ более сложен в плане теоретического описания, чем гомогенный. Если в гомогенном катализе катализатор находится в молекулярном состоянии, которое можно строго описать термодинамически, то в гетерогенном катализе, как правило, неясно, что принимать за молекулярную единицу катализатора и как охарактеризовать состояние молекул, находящихся на границе с твердой фазой катализатора. Поэтом для физико-химических описания различных стадий гетерогенно-каталитического процесса часто прибегают к условным понятиям и приближенным моделям.
Таблица 1. Примеры промышленных каталитических процессов
| Название процесса | Каталитическая реакция | Катализатор |
| Окисление | 


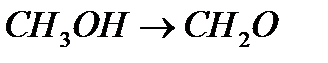
| 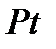

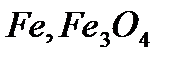

|
| Синтез | 
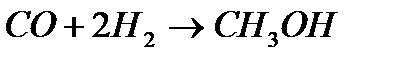
| 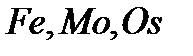
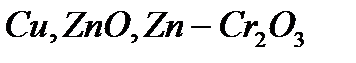
|
| Гидрирование и дегидрирование | 
| Оксиды и сульфиды переходных металлов |
Большая роль в гетерогенном катализе принадлежит процессам адсорбции. Адсорбция – экзоэргический процесс, сопровождающийся ростом концентрации упорядоченности адсорбтива на поверхности адсорбента. Адсорбирющее твердое вещество называют адсорбентом; вещество, которое адсорбируется, – адсорбтивом [4].
Адсорбция может происходить под влиянием «физических» сил, сходных с силами, действующими при сжигании газов, или под влияние «химических» сил, аналогичных силам, участвующим в образовании обычных химических соединений. Поэтому принято различать физическую адсорбцию (называемую также вандерваальсовой адсорбцией, для того чтобы подчеркнуть физическую природу действующих сил) и химическую адсорбцию, или хемосорбцию [2]. Физическая адсорбция является результатом межмолекулярного взаимодействия между частицами (атомами, ионами, молекулами) поверхностного слоя твердой фазы и молекулами газовой фазы или раствором. Хемосорбция завершается химическим взаимодействием адсорбированного вещества с поверхностью твердой
фазы [4].
Дата добавления: 2015-08-17; просмотров: 257 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Глава 1. Катализ | | | Глава 2. Основные механизмы катализа |