
|
Читайте также: |
В жировой ткани для синтеза жиров используются в основном жирные кислоты, освободившиеся при гидролизе жиров ХМ и ЛПОНП. Жирные кислоты поступают в адипоциты, превращаются в производные КоА и взаимодействуют с глицерол-3-фосфатом, образуя сначала лизофосфатидную кислоту, а затем фосфатидную. Фосфатидная кислота после дефосфорилирования превращается в диацилглицерол, который ацилируется с образованием триацилглицерола.
Кроме жирных кислот, поступающих в адипоциты из крови, в этих клетках идёт и синтез жирных кислот из продуктов распада глюкозы. В адипоцитах для обеспечения реакций синтеза жира распад глюкозы идёт по двум путям: гликолиз, обеспечивающий образование глицерол-3-фосфата и ацетил-КоА, и пентозофосфатный путь, окислительные реакции которого обеспечивают образование NADPH, служащего донором водорода в реакциях синтеза жирных кислот.
Молекулы жиров в адипоцитах объединяются в крупные жировые капли, не содержащие воды, и поэтому являются наиболее компактной формой хранения топливных молекул. Подсчитано, что, если бы энергия, запасаемая в жирах, хранилась в форме сильно гидратированных молекул гликогена, то масса тела человека увеличилась бы на 14-15 кг. Печень - основной орган, где идёт синтез жирных кислот из продуктов гликолиза. В гладком ЭР гепатоцитов жирные кислоты активируются и сразу же используются для синтеза жиров, взаимодействуя с глицерол-3-фосфатом. Как и в жировой ткани, синтез жиров идёт через образование фосфатидной кислоты. Синтезированные в печени жиры упаковываются в ЛПОНП и секретируются в кровь

| Типы липопротеинов | Хиломикроны (ХМ) | ЛПОНП | ЛППП | ЛПНП | ЛПВП |
| Состав, % | |||||
| Белки | |||||
| ФЛ | |||||
| ХС | |||||
| ЭХС | |||||
| ТАГ | |||||
| Функции | Транспорт липидов из клеток кишечника(экзогенных липидов) | Транспорт липидов, синтезируемых в печени (эндогенных липидов) | Промежуточная форма превращения ЛПОНП в ЛПНП под действием фермента ЛП-липазы | Транспорт холестерола в ткани | Удаление избытка холестерола из клеток и других липопротеинов. Донор апопротеинов А, С-П |
| Место образования | Эпителий тонкого кишечника | Клетки печени | Кровь | Кровь (из ЛПОНП и ЛППП) | Клетки печени - ЛПВП-пред-шественники |
| Плотность, г/мл | 0,92-0,98 | 0,96-1,00 | 1,00-1,06 | 1,06-1,21 | |
| Диаметр частиц, нМ | Больше 120 | 30-100 | 21-100 | 7-15 | |
| Основные аполипопротеины | В-48 С-П Е | В-100 С-П Е | В-100 Е | В-100 | A-I С-II Е |
В состав ЛПОНП, кроме жиров, входят холестерол, фосфолипиды и белок - апоВ-100. Это очень "длинный" белок, содержащий 11 536 аминокислот. Одна молекула апоВ-100 покрывает поверхность всего липопротеина.
ЛПОНП из печени секретируются в кровь, где на них, как и на ХМ, действует ЛП-липаза. Жирные кислоты поступают в ткани, в частности в адипоциты, и используются для синтеза жиров. В процессе удаления жиров из ЛПОНП под действием ЛП-липазы ЛПОНП сначала превращаются в ЛППП, а затем в ЛПНП. В ЛПНП основными липидными компонентами служат холестерол и его эфиры, поэтому ЛПНП являются липопротеинами, доставляющими холестерол в периферические ткани. Глицерол, освободившийся из липопротеинов, кровью транспортируется в печень, где опять может использоваться для синтеза жиров.

51. Регуляция содержания глюкозы в крови.
Концентрация глюкозы в артериальной крови в течение суток поддерживается на постоянном уровне 60-100 мг/дл (3,3-5,5 ммоль/л). После приёма углеводной пищи уровень глюкозы возрастает в течение примерно 1 ч до 150 мг/дл
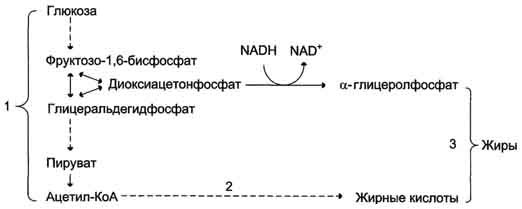
Рис. 7-58. Синтез жира из углеводов. 1 - окисление глюкозы до пирувата и окислительное декарбоксилирование пирувата приводят к образованию ацетил-КоА; 2 - ацетил-КоА является строительным блоком для синтеза жирных кислот; 3 - жирные кислоты и а-глицеролфосфат, образующийся в реакции восстановления дигидроксиацетонфосфата, участвуют в синтезе триа-цилглицеролов.
(∼8 ммоль/л, алиментарная гипергликемия), а затем возвращается к нормальному уровню (примерно через 2 ч). На рисунке 7-59 представлен график изменений концентрации глюкозы в крови в течение суток при трёхразовом приёме пищи.
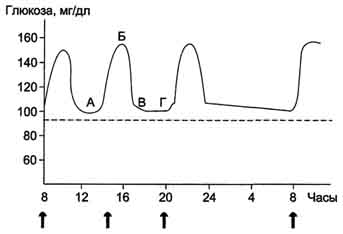
Рис. 7-59. Изменение концентрации глюкозы в крови в течение суток. А, Б - период пищеварения; В, Г - постабсорбтивный период. Стрелкой указано время приёма пищи, пунктиром показана нормальная концентрация глюкозы.
А. Регуляция содержания глюкозы в крови в абсорбтивном и постабсорбтивном периодах
Для предотвращения чрезмерного повышения концентрации глюкозы в крови при пищеварении основное значение имеет потребление глюкозы печенью и мышцами, в меньшей мере - жировой тканью. Следует напомнить, что более половины всей глюкозы (60%), поступающей из кишечника в воротную вену, поглощается печенью. Около 2/3 этого количества откладывается в печени в форме гликогена, остальная часть превращается в жиры и окисляется, обеспечивая синтез АТФ. Ускорение этих процессов инициируется повышением инсулинглюкагонового индекса. Другая часть глюкозы, поступающей из кишечника, попадает в общий кровоток. Примерно 2/3 этого количества поглощается мышцами и жировой тканью. Это обусловлено увеличением проницаемости мембран мышечных и жировых клеток для глюкозы под влиянием высокой концентрации инсулина. Глюкоза в мышцах откладывается в форме гликогена, а в жировых клетках превращается в жиры. Остальная часть глюкозы общего кровотока поглощается другими клетками (инсулинонезависимыми).
При нормальном ритме питания и сбалансированном рационе концентрация глюкозы в крови и снабжение глюкозой всех органов поддерживается главным образом за счёт синтеза и распада гликогена. Лишь к концу ночного сна, т.е. к концу самого большого перерыва между приёмами пищи, может несколько увеличиться роль глюконеогенеза, значение которого будет возрастать, если завтрак не состоится и голодание продолжится (рис. 7-60).

Рис. 7-60. Источники глюкозы в крови в период пищеварения и во время голодания. 1 - в период пищеварения углеводы пищи являются основным источником глюкозы в крови; 2 - в постабсорбтивный период печень поставляет глюкозу в кровь за счёт процессов гликогенолиза и глюконеогенеза, причём в течение 8-12 ч уровень глюкозы в крови поддерживается в основном за счёт распада гликогена; 3 - глюконеогенез и гликоген в печени участвуют в равной степени в поддержании нормальной концентрации глюкозы; 4 - в течение суток гликоген печени практически полностью исчерпывается, и скорость глюконеогенеза увеличивается; 5 - при длительном голодании (1 нед и более) скорость глюконеогенеза уменьшается, но глюконеогенез остаётся единственным источником глюкозы в крови.
Б. Регуляция содержания глюкозы в крови при предельном голодании
При голодании в течение первых суток исчерпываются запасы гликогена в организме, и в дальнейшем источником глюкозы служит только глюконеогенез (из лактата, глицерина и аминокислот). Глюконеогенез при этом ускоряется, а гликолиз замедляется вследствие низкой концентрации инсулина и высокой концентрации глюкагона (механизм этого явления описан ранее). Но, кроме того, через 1-2 сут существенно проявляется действие и другого механизма регуляции - индукции и репрессии синтеза некоторых ферментов: снижается количество гликолитических ферментов и, наоборот, повышается количество ферментов глюконеогенеза. Изменение синтеза ферментов также связано с влиянием инсулина и глюкагона (механизм действия рассматривается в разделе 11).
Начиная со второго дня голодания достигается максимальная скорость глюконеогенеза из аминокислот и глицерина. Скорость глюконеогенеза из лактата остаётся постоянной. В результате синтезируется около 100 г глюкозы ежесуточно, главным образом в печени.
Следует отметить, что при голодании глюкоза не используется мышечными и жировыми клетками, поскольку в отсутствие инсулина не проникает в них и таким образом сберегается для снабжения мозга и других глюкозозависимых клеток. Поскольку при других условиях мышцы - один из основных потребителей глюкозы, то прекращение потребления глюкозы мышцами при голодании имеет существенное значение для обеспечения глюкозой мозга. При достаточно продолжительном голодании (несколько дней и больше) мозг начинает использовать и другие источники энергии (см. раздел 8).
Вариантом голодания является несбалансированное питание, в частности такое, когда по калорийности рацион содержит мало углеводов - углеводное голодание. В этом случае также активируется глюконеогенез, и для синтеза глюкозы используются аминокислоты и глицерол, образующиеся из пищевых белков и жиров.
В. Регуляция содержания глюкозы в крови в период покоя и во время физической нагрузки
Как в период покоя, так и во время продолжительной физической работы сначала источником глюкозы для мышц служит гликоген, запасённый в самих мышцах, а затем глюкоза крови. Известно, что 100 г гликогена расходуется на бег примерно в течение 15 мин, а запасы гликогена в мышцах после приёма углеводной пищи могут составлять 200-300 г. На рисунке 7-61 представлены значения гликогена печени и глюконеогенеза для обеспечения глюкозой работы мышц разной интенсивности и продолжительности. Регуляция мобилизации гликогена в мышцах и печени, а также глюконеогенеза в печени описана ранее (главы VII, X).

Рис. 7-61. Вклад гликогена печени и глюконеогенеза в поддержание уровня глюкозы крови в период покоя и во время продолжительных физических упражнений. Тёмная часть столбика-вклад гликогена печени в поддержание уровня глюкозы в крови; светлая - вклад глюконеогенеза. При увеличении продолжительности физической нагрузки с 40 мин (2) до 210 мин (3) распад гликогена и глюконеогенез практически в равной степени обеспечивают кровь глюкозой. 1 - состояние покоя (постабсорбтивный период); 2,3 - физическая нагрузка.
Итак, изложенные сведения позволяют сделать вывод о том, что координация скоростей гликолиза, глюконеогенеза, синтеза и распада гликогена с участием гормонов обеспечивает:
52. Инсулин. Строение, образование из проинсулина. Изменение концентрации в зависимости от режима питания.
Инсулин - белковый гормон, синтезируется и секретируется в кровь р-клетками островков Лангерханса поджелудочной железы, β-клетки чувствительны к изменениям содержания глюкозы в крови и секретируют инсулин в ответ на повышение её содержания после приёма пищи. Транспортный белок (ГЛЮТ-2), обеспечивающий поступление глюкозы в β-клетки, отличается низким сродством к ней. Следовательно, этот белок транспортирует глюкозу в клетку поджелудочной железы лишь после того, как её содержание в крови будет выше нормального уровня (более 5,5 ммоль/л).
В β-клетках глюкоза фосфорилируется глюкокиназой, имеющей также высокую Кm для глюкозы - 12 ммоль/л. Скорость фосфорилирования глюкозы глюкокиназой в β-клетках прямо пропорциональна её концентрации в крови.
Синтез инсулина регулируется глюкозой. Глюкоза (или её метаболиты), по-видимому, непосредственно участвуют в регуляции экспрессии гена инсулина. Секреция инсулина и глюкагона также регулируется глюкозой, которая стимулирует секрецию инсулина из β-клеток и подавляет секрецию глюкагона из α-клеток. Кроме того, сам инсулин снижает секрецию глюкагона (см. раздел 11).
Синтез и выделение инсулина представляют собой сложный процесс, включающий несколько этапов. Первоначально образуется неактивный предшественник гормона, который после ряда химических превращений в процессе созревания превращается в активную форму. Инсулин вырабатывается в течение всего дня,а не только в ночные часы.
Ген, кодирующий первичную структуру предшественника инсулина, локализуется в коротком плече 11 хромосомы.
На рибосомах шероховатой эндоплазматической сети синтезируется пептид-предшественник — т. н. препроинсулин. Он представляет собой полипептидную цепь, построенную из 110 аминокислотных остатков и включает в себя расположенные последовательно: L-пептид, B-пептид, C-пептид и A-пептид.
Почти сразу после синтеза в ЭПР от этой молекулы отщепляется сигнальный (L) пептид — последовательность из 24 аминокислот, которые необходимы для прохождения синтезируемой молекулы через гидрофобную липидную мембрану ЭПР. Образуется проинсулин, который транспортируется в комплекс Гольджи, далее в цистернах которого происходит так называемое созревание инсулина.
Созревание является наиболее длительным этапом образования инсулина. В процессе созревания из молекулы проинсулина с помощью специфических эндопептидаз вырезается C-пептид — фрагмент из 31 аминокислоты, соединяющий B-цепь и A-цепь. То есть молекула проинсулина разделяется на инсулин и биологически инертный пептидный остаток.
В секреторных гранулах инсулин, соединяясь с ионами цинка, образует кристаллические гексамерные агрегаты.
53. Роль инсулина в регуляции обмена углеводов, липидов и аминокислот.
Так или иначе инсулин затрагивает все виды обмена веществ во всём организме. Однако в первую очередь действие инсулина касается именно обмена углеводов. Основное влияние инсулина на углеводный обмен связано с усилением транспорта глюкозы через клеточные мембраны. Активация инсулинового рецептора запускает внутриклеточный механизм, который напрямую влияет на поступление глюкозы в клетку путём регуляции количества и работы мембранных белков, переносящих глюкозу в клетку.
В наибольшей степени от инсулина зависит транспорт глюкозы в двух типах тканей: мышечная ткань (миоциты) и жировая ткань (адипоциты) — это т. н. инсулинозависимые ткани. Составляя вместе почти 2/3 всей клеточной массы человеческого тела, они выполняют в организме такие важные функции как движение, дыхание, кровообращение и т. п., осуществляют запасание выделенной из пищи энергии.
Механизм действия
Подобно другим гормонам своё действие инсулин осуществляет через белок-рецептор.
Инсулиновый рецептор представляет собой сложный интегральный белок клеточной мембраны, построенный из 2 субъединиц (a и b), причём каждая из них образована двумя полипептидными цепочками.
Инсулин с высокой специфичностью связывается и распознаётся а-субъединицей рецептора, которая при присоединении гормона изменяет свою конформацию. Это приводит к появлению тирозинкиназной активности у субъединицы b, что запускает разветвлённую цепь реакций по активации ферментов, которая начинается с аутофосфорилирования рецептора.
Весь комплекс биохимических последствий взаимодействия инсулина и рецептора ещё до конца не вполне ясен, однако известно, что на промежуточном этапе происходит образование вторичных посредников: диацилглицеролов и инозитолтрифосфата, одним из эффектов которых является активация фермента — протеинкиназы С, с фосфорилирующим (и активирующим) действием которой на ферменты и связаны изменения во внутриклеточном обмене веществ.
Усиление поступления глюкозы в клетку связано с активирующим действием посредников инсулина на включение в клеточную мембрану цитоплазматических везикул, содержащих белок-переносчик глюкозы GLUT 4.
Физиологические эффекты инсулина
Инсулин оказывает на обмен веществ и энергии сложное и многогранное действие. Многие из эффектов инсулина реализуются через его способность действовать на активность ряда ферментов.
Инсулин — единственный гормон, снижающий содержание глюкозы в крови, это реализуется через:
усиление поглощения клетками глюкозы и других веществ;
активацию ключевых ферментов гликолиза;
увеличение интенсивности синтеза гликогена — инсулин форсирует запасание глюкозы клетками печени и мышц путём полимеризации её в гликоген;
уменьшение интенсивности глюконеогенеза — снижается образование в печени глюкозы из различных веществ
Анаболические эффекты
усиливает поглощение клетками аминокислот (особенно лейцина и валина);
усиливает транспорт в клетку ионов калия, а также магния и фосфата;
усиливает репликацию ДНК и биосинтез белка;
усиливает синтез жирных кислот и последующую их этерификацию — в жировой ткани и в печени инсулин способствует превращению глюкозы в триглицериды; при недостатке инсулина происходит обратное — мобилизация жиров.
Антикатаболические эффекты
подавляет гидролиз белков — уменьшает деградацию белков;
уменьшает липолиз — снижает поступление жирных кислот в кровь.
54. Сахарный диабет. Важнейшие изменения гормонального статуса и обмена веществ.55. Патогенез основных симптомов сахарного диабета.
Сахарный диабет. В регуляции гликолиза и глюконеогенеза большую роль играет инсулин. При недостаточности содержания инсулинавозникает заболевание, которое носит название «сахарный диабет»: повышается концентрация глюкозы в крови (гипергликемия), появляется глюкоза в моче (глюкозурия) и уменьшается содержание гликогена в печени. Мышечная ткань при этом утрачивает способность утилизировать глюкозу крови. В печени при общем снижении интенсивности биосинтетических процессов: биосинтезабелков, синтеза жирных кислот из продуктов распада глюкозы – наблюдается усиленный синтез ферментов глюконеогенеза. При введении инсулина больным диабетом происходит коррекция метаболических сдвигов: нормализуется проницаемость мембранмышечных клеток для глюкозы, восстанавливается соотношение между гликолизом и глюко-неогенезом. Инсулин контролирует эти процессы на генетическом уровне как индуктор синтеза ключевых ферментов гликолиза: гексокиназы, фос-фофруктокиназы ипируваткиназы. Инсулин также индуцирует синтез гли-когенсинтазы. Одновременно инсулин действует как репрессор синтеза ключевыхферментов глюконеогенеза. Следует отметить, что индукторами синтеза ферментов глюконеогенеза служат глюкокортикоиды. В связи с этим при инсулярной недостаточности и сохранении или даже повышении секреции кортикостероидов (в частности, при диабете) устранение влияния инсулина приводит к резкому повышению синтеза и концентрации ферментов глюкон
В патогенезе сахарного диабета выделяют два основных момента:
1) недостаточное производство инсулина эндокринными клетками поджелудочной железы,
2) нарушение взаимодействия инсулина с клетками тканей организма (инсулинорезистентность) как следствие изменения структуры или уменьшения количества специфических рецепторов для инсулина, изменения структуры самого инсулина или нарушения внутриклеточных механизмов передачи сигнала от рецепторов органелламклетки.
Существует наследственная предрасположенность к сахарному диабету. Если болен один из родителей, то вероятность унаследовать диабет первого типа равна 10 %, а диабет второго типа — 80 %.
Панкреатическая недостаточность (1-й тип диабета) Первый тип нарушений характерен для диабета 1-го типа (устаревшее название — инсулинозависимый диабет). Отправным моментом в развитии этого типа диабета является массивное разрушение эндокринных клеток поджелудочной железы (островков Лангерганса) и, как следствие, критическое снижение уровня инсулина в крови. Массовая гибель эндокринных клеток поджелудочной железы может иметь место в случае вирусных инфекций, онкологических заболеваний, панкреатита, токсических поражений поджелудочной железы, стрессовых состояний, различных аутоиммунных заболеваний, при которых клетки иммунной системы вырабатывают антитела против β-клеток поджелудочной железы, разрушая их. Этот тип диабета, в подавляющем большинстве случаев, характерен для детей и лиц молодого возраста (до 40 лет). У человека это заболевание зачастую является генетически детерминированным и обусловленным дефектами ряда генов, расположенных в 6-й хромосоме. Эти дефекты формируют предрасположенность к аутоиммунной агрессии организма к клеткам поджелудочной железы и отрицательно сказываются на регенерационной способности β-клеток. В основе аутоиммунного поражения клеток лежит их повреждение любыми цитотоксическими агентами. Данное поражение вызывает выделение аутоантигенов, которые стимулируют активность макрофагов и Т-киллеров, что в свою очередь, приводит к образованию и выделению в кровь интерлейкинов в концентрациях, оказывающих токсическое действие на клетки поджелудочной железы. Также клетки повреждаются находящимися в тканях железы макрофагами. Также провоцирующими факторами могут являться длительная гипоксия клеток поджелудочной железы и высокоуглеводистая, богатая жирами и бедная белками диета, что приводит к снижению секреторной активности клеток островковых клеток и в перспективе к их гибели. После начала массивной гибели клеток запускается механизм их аутоиммунного поражения.
Внепанкреатическая недостаточность (2-й тип диабета). Для диабета 2-го типа (устаревшее название — инсулинонезависимый диабет) характерны нарушения, указанные в пункте 2 (см. выше). При этом типе диабета инсулин производится в нормальных или даже в повышенных количествах, однако нарушается механизм взаимодействия инсулина с клетками организма (инсулинорезистентность). Главной причиной инсулинрезистентности является нарушение функций мембранных рецепторов инсулина при ожирении (основной фактор риска, 80 % больных диабетом имеют избыточную массу тела) — рецепторы становятся неспособными взаимодействовать с гормоном в силу изменения их структуры или количества. Также при некоторых видах диабета 2-го типа может нарушаться структура самого инсулина (генетические дефекты). Наряду с ожирением, пожилой возраст, вредные привычки, артериальная гипертония, хроническое переедание, малоподвижный образ жизни также являются факторами риска для сахарного диабета 2-го типа. В целом этот вид диабета наиболее часто поражает людей старше 40 лет. Доказана генетическая предрасположенность к диабету 2-го типа, на что указывает 100 % совпадение наличия заболевания у гомозиготных близнецов. При сахарном диабете 2 типа часто наблюдается нарушение циркадных ритмов синтеза инсулина и относительно длительное отсутствие морфологических изменений в тканях поджелудочной железы. В основе заболевания лежит ускорение инактивации инсулина или же специфическое разрушение рецепторов инсулина на мембранах инсулин-зависимых клеток. Ускорение разрушения инсулина зачастую происходит при наличии портокавальных анастомозов и, как следствие, быстрого поступления инсулина из поджелудочной железы в печень, где он быстро разрушается. Разрушение рецепторов к инсулину является следствием аутоиммунного процесса, когда аутоантитела воспринимают инсулиновые рецепторы как антигены и разрушают их, что приводит к значительному снижению чувствительности к инсулину инсулинзависимых клеток. Эффективность действия инсулина при прежней концентрации его в крови становится недостаточной для обеспечения адекватного углеводного обмена.
В результате этого развиваются первичные и вторичные нарушения.
Первичные.
• Замедление синтеза гликогена
• Замедление скорости глюконидазной реакции
• Ускорение глюконеогенеза в печени
• Глюкозурия
• Гипергликемия
Вторичные
• Снижение толерантности к глюкозе
• Замедление синтеза белка
• Замедление синтеза жирных кислот
• Ускорение высвобождение белка и жирных кислот из депо
• Нарушается фаза быстрой секреции инсулина в β-клетках при гипергликемии.
•
В результате нарушений углеводного обмена в клетках поджелудочной железы нарушается механизм экзоцитоза, что, в свою очередь, приводит к усугублению нарушений углеводного обмена. Вслед за нарушениям углеводного обмена закономерно начинают развиваться нарушения жирового и белкового обмена.Независимо от механизмов развития, общей чертой всех типов диабета является стойкое повышение уровня глюкозы в крови и нарушение метаболизма тканей организма, неспособных более усваивать глюкозу.
• Неспособность тканей использовать глюкозу приводит к усиленному катаболизму жиров и белков с развитием кетоацидоза.
• Повышение концентрации глюкозы в крови приводит к повышению осмотического давления крови, что обусловливает серьёзную потерю воды и электролитов с мочой.
• Стойкое повышение концентрации глюкозы в крови негативно влияет на состояние многих органов и тканей, что в конце концов приводит к развитию тяжёлых осложнений, таких как диабетическая нефропатия, нейропатия, офтальмопатия, микро- и макроангиопатия, различные виды диабетических ком и других.
• У больных диабетом наблюдается снижение реактивности иммунной системы и тяжёлое течение инфекционных заболеваний.
Сахарный диабет, как и, к примеру гипертоническая болезнь, является генетически, патофизиологически, клинически неоднородным заболеванием.
56. Биохимический механизм развития диабетической комы.57. Патогенез поздних осложнений сахарного диабета (микро- и макроангиопатии, ретинопатия, нефропатия, катаракта).
Поздние осложнения сахарного диабета представляют собой группу осложнений, на развитие которых требуются месяцы, а в большинстве случаев годы течения заболевания.
• Диабетическая ретинопатия — поражение сетчатки глаза в виде микроаневризм, точечных и пятнистых кровоизлияний, твёрдых экссудатов, отёка, образования новых сосудов. Заканчивается кровоизлияниями на глазном дне, может привести к отслоению сетчатки. Начальные стадии ретинопатии определяются у 25 % больных с впервые выявленным сахарным диабетом 2-го типа. Частота заболевания ретинопатией увеличивается на 8 % в год, так что через 8 лет от начала заболевания ретинопатия выявляется уже у 50 % всех больных, а через 20 лет приблизительно у 100 % больных. Чаще встречается при 2-м типе, степень её выраженности коррелирует с выраженностью нейропатии. Главная причина слепоты у лиц среднего и пожилого возраста.
• Диабетическая микро- и макроангиопатия — нарушение проницаемости сосудов, повышение их ломкости, склонность к тромбозам и развитию атеросклероза (возникает рано, поражаются преимущественно мелкие сосуды).
• Диабетическая полинейропатия — чаще всего в виде двусторонней периферической нейропатии по типу «перчаток и чулок», начинающаяся в нижних частях конечностей. Потеря болевой и температурной чувствительности — наиболее важный фактор в развитии нейропатических язв и вывихов суставов. Симптомами периферической нейропатии является онемение, чувство жжения или парестезии, начинающиеся в дистальных областях конечности. Характерно усиление симптоматики в ночное время. Потеря чувствительности приводит к легко возникающим травмам.
• Диабетическая нефропатия — поражение почек, сначала в виде микроальбуминурии (выделения белка альбумина с мочой), затем протеинурии. Приводит к развитиюхронической почечной недостаточности.
• Диабетическая артропатия — боли в суставах, «хруст», ограничение подвижности, уменьшение количества синовиальной жидкости и повышение её вязкости.
• Диабетическая офтальмопатия — раннее развитие катаракты (помутнения хрусталика), ретинопатии (поражение сетчатки).
• Диабетическая энцефалопатия — изменения психики и настроения, эмоциональная лабильность или депрессия.
• Диабетическая стопа — поражение стоп больного сахарным диабетом в виде гнойно-некротических процессов, язв и костно-суставных поражений, возникающее на фоне изменения периферических нервов, сосудов, кожи и мягких тканей, костей и суставов. Является основной причиной ампутаций у больных сахарным диабетом.
Диабетическая кома — состояние, развивающееся из-за недостатка инсулина в организме у больных сахарным диабетом.
• гипогликемическая кома — от недостатка сахара в крови - Гипогликемическая кома развивается при снижении уровня сахара в крови ниже 2,8 ммоль/л, что сопровождается возбуждением симпатической нервной системы и дисфункцией ЦНС. При гипогликемии кома развивается остро, больной чувствует озноб, голод, дрожь в теле, теряет сознание, изредка при этом бывают недолгие судороги. При утрате сознания отмечается обильная потливость: больной мокрый, «хоть выжимай», пот холодный.
• гипергликемическая кома — от избытка сахара в крови - ипергликемическая кома развивается постепенно, в течение суток и более, сопровождается сухостью во рту, больной много пьёт, если в этот момент взять кровь на анализ сахара; то показатели повышены (в норме 3,3-5,5 ммоль/л) в 2-3 раза.Её появлению предшествуют недомогание, ухудшение аппетита, головная боль, запоры или поносы, тошнота, иногда боли в животе, изредка рвота. Если в начальный период развития диабетической комы своевременно не начать лечение, больной переходит в состояние прострации (безразличия, забывчивости, сонливости); сознание его затемнено. Отличительной особенностью комы является то, что кроме полной утраты сознания, кожа сухая, тёплая на ощупь, изо рта запах яблок или ацетона, слабый пульс, пониженное артериальное давление. Температура тела нормальная или немного повышена. Глазные яблоки мягкие на ощупь.
Дата добавления: 2015-08-17; просмотров: 147 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Синтез глюкозы из глицерина и аминокислот. | | | Ньон - Женева - Лозанна - Монтре - Грюйер. |