
Читайте также:
|
К принципам, позволяющим более эффективно решить задачу синтеза ХТС методом декомпозиции можно отнести эвристический принцип синтеза ХТС, который заключается в математической формализации интуитивно-эвристического метода, широко используемого проектировщиками, и, позволяющего высококвалифицированным специалистам интуитивно выбирать наиболее удачные варианты решения проблемы без полного перебора всех возможных альтернативных вариантов. При использовании данного метода принятие решения происходит без обоснования его с помощью доказательств. Однако данный способ принятия решений не снижает его ценности, так как он использует интуитивные факторы и правила, т.е. обобщающие знания и большой практический опыт высококвалифицированных специалистов.
Рассмотри некоторые эвристики, применяемые при разработке технологических схем ряда функциональных подсистем химических производств. Например, для выбора оптимальной технологической схемы разделения многокомпонентных смесей из множества альтернативных вариантов можно использовать следующие эвристики:
а)выбор варианта с последовательным выделением целевых продуктов в виде легких продуктов элементов подсистемы;
б)выбор варианта, в котором отношение количеств верхнего и нижнего продуктов в каждом элементе подсистемы наиболее близко к 1;
в)выбор варианта, в котором разделение компонентов осуществляется в порядке уменьшения различий в значениях относительных летучестей разделяемых ключевых компонентов;
г)ректификационные колонны, требующие наибольших затрат на разделение вследствие близких относительных летучестей ключевых компонентов или высоких требований к чистоте продуктов, должны быть помещены в конце схемы разделения;
д)выбор варианта, характеризующегося минимальной величиной приведенных затрат на реализацию данного технологического процесса в элементе подсистемы и т.д.
При разработке оптимальных технологических схем тепловых подсистем (систем теплообменников) могут использоваться следующие эвристики:
а)выбирается пара потоков, для которой количество передаваемого тепла является максимальным;
б)выбирается пара потоков, для которой заданные конечные температуры потоков не достигнуты, а стоимость использования вспомогательных теплоносителей для доведения температуры этих потоков до заданных конечных значений является минимальной;
в)выбирается пара потоков, стоимость нагрева/охлаждения которых вспомогательными тепло-/хладоносителями является максимальной;
г)выбирается пара потоков, для которой стоимость теплообмена является минимальной и т.д.
При применении эвристического принципа синтеза успех в основном зависит от того, насколько близки эвристические условия к условиям достижения оптимальности рассматриваемой подсистемы ХТС, а также от порядка применения эвристических условий, типа синтезируемой подсистемы, ее сложности, параметров потоков и пр. Для определения данного порядка применения эвристик используют весовые функции отдельных эвристик.
Рассчитанная, с помощью какой-либо методики, величина приведенных затрат сравнивается с минимальным значением, полученным ранее. Если полученное решение получится более экономичным, то весовые коэффициенты использованных эвристик увеличиваются, в противном случае – уменьшаются. Если весовой коэффициент эвристики будет равен нулю, то данная эвристика далее не используется.
Процесс синтеза ХТС ведут до тех пор, пока снижается приведенная стоимость затрат. При стабилизации приведенной стоимости затрат на некотором минимальном значении, расчеты прекращают.
Рассмотренные принципы синтеза ХТС достаточно широко применяются при синтезе новых производств, однако при реконструкции существующих производств, применение данных принципов приведет к рассмотрению избыточного количества вариантов и может быть недостаточно эффективно. Для целей модернизации существующей технологической схемы, а также и для синтеза новых ХТС может использоваться эволюционный принцип синтеза.
Методологическая основа эволюционного принципа синтеза ХТС заключается в последовательной модификации аппаратурного оформления и коррекции структуры технологических связей некоторого исходного варианта ХТС с использованием методов эвристики и оптимизации. Иным образом, при использовании эволюционного принципа синтеза ХТС, сначала создается исходный вариант технологической топологии ХТС, например, с помощью эвристического принципа синтеза. С помощью методов анализа для данного варианта находится "узкое" место ХТС, определяется критерий оптимальности, и производится соответствующая модификация аппаратурного оформления и структуры технологических связей. После указанной модификации снова производится расчет критерия оптимальности и новый поиск "узкого" места ХТС. Процесс модификации ХТС производится до тех пор, пока не будет достигнуто требуемое значение критерия оптимальности. Таким образом, логически, этот процесс состоит из последовательного итерационного чередования этапов синтеза, анализа, оптимизации и модификации некоторого первоначально заданного технологического решения задачи синтеза ХТС или существующей технологической схемы.
Таким образом, практическая реализация эволюционного принципа синтеза связана с необходимостью использования следующих типов эвристик: эвристики обобщающие практический опыт (позволяющие выделить наименее эффективные элементы или узкие места в исходном варианте технологической топологии ХТС); интуитивные эвристики (позволяющие определить возможные варианты модификации или усовершенствования узких мест ХТС); эвристики, базирующиеся на знаниях высококвалифицированных специалистов (обеспечивающие возможность "стыковки" модифицированного элемента ХТС с немодифицированной частью ХТС).
К сожалению, использование эволюционного принципа синтеза ХТС позволяет с наибольшей эффективностью получить локальные оптимальные результаты, что обусловлено тем, что результат решения в значительной мере определяется принятыми на первом этапе основными концепциями при разработке исходного варианта технологической топологии ХТС.
4. АНАЛИЗ ХИМИКО-ТЕХНОЛОГИЧЕСКОЙ СИСТЕМЫ
4.1. Задачи анализа ХТС.
Задачи анализа ХТС заключаются в получении сведений о функционировании системы в зависимости от принятой химической схемы, структуры технологических связей между элементами и подсистемами, а так же от конструкционных и технологических параметров, исходя из заданных свойств и показателей функционирования, имеющих оптимальное значение.
Для этого необходимы: а) технологический анализ ХТС – получение технологических показателей: температуры, давления, размеров потоков, выхода и селективности, количества отходов и т.д.; б) технико-экономический анализ ХТС - получение экономических критериев оценки эффективности системы - расходных коэффициентов, затрат на производство продуктов и т.д. и в конечном счете, получение сведений о себестоимости продукции; в) анализ функционирования системы. - устойчивость, надежность, безопасность работы и др.
При этом необходимо учитывать, что ХТС обладает свойствами, не характерными для отдельных её элементов, что обусловлено взаимозависимостью режимов элементов.
Анализ ХТС осуществляется при разработке и проектировании системы для определения её эффективности, а также для сравнения различных вариантов реализации процесса с целью выбора из них оптимального. Анализ используется и при модернизации и реконструкции действующих ХТС. Приведенные выше показатели работы ХТС находятся в результате решения систем уравнений материальных и тепловых балансов.
4.2 Материально тепловые балансы химико-технологических систем.
Балансы ХТС передают законы сохранения массы - материальные балансы и энергии - энергетические балансы, в частности тепловые балансы. Балансы ХТС составляются как правило для стационарных процессов, либо для ХТС в целом, либо для отдельных элементов или групп элементов. В последних случаях из схемы "вырезается" элемент или совокупность элементов (рис. 4.1.).

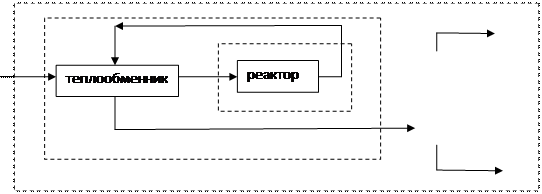
Рис. 4.1. К порядку расчета ХТС выделены:1 – один элемент; 2 - группа элементов (теплообменник, реактор);3 - ХТС в целом.
Подобное выделение отдельных элементов или группы элементов ХТС дает информацию не только об эффективности ХТС в целом, Нои её составляющих, что позволяет выявить узкие места, варьировать параметры элементов или их совокупность и направленно осуществлять интенсификацию ХТС.
Материальный баланс - основывается на том, что во всякой замкнутой системе масса веществ, вступивших в реакцию равна массе веществ образовавшихся в результате взаимодействия.
Например, в реактор поступают вещества с массой G1, G2,G3,…Gs. В результате взаимодействия получают R продуктов с массой G”1, G”2, G”3,…G”R. Уравнение баланса такой системы будет:
G1+G2+G3+…+Gs= G”1+G”2+G”3+…+G”R
или 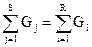 (4.1.а)
(4.1.а)
или 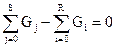 (4.1б)
(4.1б)
Тепловой баланс основан на том, что приход теплоты в данном процессе равен расходу ее в том же процессе. Если принять, например, что в адиабатическом реакторе протекает экзотермическая реакция то уравнение баланса будет:
QP+G1 *H1+… +GS *HS= G’1 *H’1 +….+ GR *HR (4.2.)
или 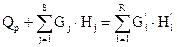 , (4.2а)
, (4.2а)
или 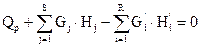 (4.2.б)
(4.2.б)
где Нj, H’i-энтальпия веществ поступивших в реактор и продуктов реакции; Qр - теплота химической реакции.
Уравнения (4.1а),(4.1б),(4.2а),(4.2б) справедливы для разомкнутых систем. Для замкнутых систем при составлении балансов учитывается наличие рециркуляции технологических потоков.
Тогда в соответствии с рис. 11 уравнение баланса будет:
GП=G0+GR (4.3)
Соотношение потоков в системах с рециклом, как указывалось, учитывает коэффициент рециркуляции – КR и отношение рециркуляции - R.Тогда, поскольку:
КR= GП/G0 и R=GR/GП (4.4.)
уравнение баланса принимает вид:
GП=G0 + R*GП = G0 /(1-R) (4.4а)
Или GП= КR*G0 (4.5)
4.2.1. Балансовые соотношения
Для составления балансов используются стехиометрические, термохимические, термодинамические и межфазовые соотношения.
Стехиометрические балансовые соотношения отражают количественные изменения состава системы. Например, в реакции:
2 С + 02 = 2 СО
Из трех молей исходных веществ (углерода и кислорода) получается два моля продукта (оксида углерода). Это учитывается при составлении балансов с помощью стехиометрических коэффициентов - ν.
Реагирующие компоненты обозначаются как G1, G2,…Gj. Если, в смеси имеется S веществ, то j= 1,2.. S. При переносе всех символов в одну часть химического уравнения баланса оно принимает вид:
ν1*G1+ν2*G2… +νj Gj=0 (4.6а)
где принято для исходных веществ ν > 0, для продуктов реакций ν<0.
Для приведенной выше реакции ν1=+2; ν2=+1; ν3=-2.
Уравнение (4.6а)записывается в виде: 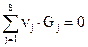 (4.6.б)
(4.6.б)
Это уравнение называется стехиометрическим уравнением реакции в алгебраической форме.
Если в системе протекает несколько реакций, например - Rс участием S - компонентов, то уравнение (4.6.б) запишется следующим образом: 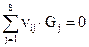 (4.7)
(4.7)
где i = 1,2,3......R; j = 1,2,3.... S; νij - стехиометрический коэффициент j -го вещества в i -ой реакции.
Для расчета сложной системы следует использовать минимальное количество уравнений химических реакций, которые отражают количественные изменения системы или состава реагирующей смеси. Исходя из этого необходимо определить какие из реакций стехиометрически независимы.
Стехиометрически зависимыми химическими реакциями называются такие стехиометрические уравнения, которых могут быть получены, как линейные комбинации других стехиометрических уравнений из числа рассматриваемых R - уравнений реакций.
Стехиометрически независимыми реакциями называют реакции, ни одно из стехиометрических уравнений которых не может быть получено путем линейной комбинацией других, и набор этих R уравнений достаточен для полного описания материального баланса.ХТС.
Термодинамические балансовые соотношения, поскольку балансы составляются для стационарных состояний, дают возможность количественного определения равновесных составов реакционных смесей. Для этого необходимо определение величины изобарно-изотермического потенциала в соответствии с уравнением Гиббса:
ΔG=ΔH - TΔS (4.8)
где Н-энтальпия системы; Т-температура; S- энтропия.
Это позволяет, во-первых, судить о наиболее вероятном пути протекания реакций и, во-вторых, количественно определить равновесный состав реакционной смеси, исходя из константы равновесия реакции, которая может быть найдена из уравнения:
ΔG0 = -R*T*lnК, (4.9)
где ΔG0 - изменение стандартного изобарно-изотермического потенциала; R- газовая постоянная; К - константа равновесия,
а также из уравнения: 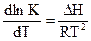 (4.10)
(4.10)
Термохимические балансовые соотношения дают сведения об изменении энтальпии при протекании химических реакций в отдельных элементах или во всей ХТС целиком. В конечном счете - о количестве теплоты, выделяющейся при экзотермических реакциях и поглощаемой при эндотермических реакциях, что определяет выбор режимов аппаратуры и структуры ХТС.
Межфазовые балансовые соотношения дают сведения о равновесии в гетерогенных системах. Для этого используются правило фаз, законы распределения веществ между фазами, диаграммы фазового равновесия, которые позволяют найти состав фаз и их свойства: агрегатное состояние, температура плавления, кипения, упругости паров и др.
Необходимо отметить что термохимические, термодинамические и межфазные балансовые соотношения используются только для анализа протекания стехиометрически независимых реакций.
В результате решения приведенных выше балансовых соотношений получают данные, необходимые для составления материальных и тепловых балансов отдельных элементов и ХТС в целом. Такие балансы часто называют э нтальпийными, поскольку в них для определения состава реакционных смесей, количество поглощенного или выделенного тепла, в соответствии с первым законом термодинамики исходят из изменения энтальпии системы.
4.3. Примеры балансов
Балансы могут быть оформлены в виде сводных таблиц, в левой части которых перечислены, а затем просуммированы все статьи прихода, в правой - все расходные статьи. Подобные таблицы приводятся, как для отдельных элементов, так и для ХТС в целом. Достоинством представления балансов в форме таблиц является их простота, наглядность, возможность непосредственного контроля результатов и их использования для определения показателей процесса.
Другим способом является графическое оформление результатов балансов в виде диаграмм, наглядно передающих соотношение между отдельными статьями приходной и расходной частей баланса.
Для быстрого обозрения результатов баланса по отдельным элементам ХТС удобно нанесение на структурную технологическую схему ХТС значений материальных и энергетических потоков.
4.3.1. Материальный и тепловой баланс узла окисления аммиака в производстве азотной кислоты, состоящего из контактного аппарата и котла-утилизатора.
В контактном аппарате протекает необратимая экзотермическая реакция:
4 NH3 + 5 O2 = 4 NO + 6 H2O + Q
Котел-утилизатор устанавливается с целью использования теплоты реакции для производства пара. В нем может происходить частичное окисление NO в NO2
Таблица 4.1
Материальный баланс (составлен на 1т 100% HNO3)
| Приход | Расход | ||
| статья | кг/т HNO3 | статья | кг/т HNO3 |
| 1. Аммиак 2. Воздух О2 N2 влага воздуха 3 Вода | 1. Нитрозные газы: NO2 NO N2 O2 H2O пар 2. Пар | 2770 164 475 | |
| Bсегo: 5617 | Всего: |
Таблица 4.2
Тепловой баланс
| П р и х о д | Р а с х о д | ||
| статья | кДж/т HNO3 | статья | кДж/т HNO3 |
| 1. С азотно-воздушной смесью | 635,36 | 1. С газами (на выходе из котла-утилизатора) | 1390,696 |
| 2. Теплота реакции окисления аммиака (в контактном аппарате) | 3883,22 | 2. На производство пара | 3678,4 |
| 3. Теплота реакции окисления NO в NO2(в котле-утилизаторе) | 638,286 | 3. В окружающую среду | 87,78 |
| Всего: | 5156,866 | Всего: | 5156,866 |
4.3.2. Материальный баланс установки термического крекинга газойля (замкнутая система), перерабатывающей 470 т газойля в сутки. При установившемся состоянии из печи крекинга выводится реакционная смесь, содержащая, масс%: газа - 4,25, бензина - 17,73; рециркулята - 66,67; крекинг-остатка - 11,35.
В данном случае решается задача определения количества получаемых продуктов и производительность печи.
Решение:
Массовая доля поступившего в реактор сырья от загрузки реактора составляет:
C=G0/Gп (4.11)
следовательно: KR=1/C (4.12)
Если обозначить через Сп массовую долю (масс. %) продукта, содержащегося в реакционной массе, выходящей из реактора, а через Со - количества подаваемого свежего сырья, то материальный баланс выражается уравнением:
C0=KR*Cп (4.13)
Коэффициент рециркуляции зависит от отношения рециркуляции, которое будет:
R = GR/G0 = 66,67/100 = 0,6667
откуда KR = 1/(1-0,6667)=3
Масс.доля (%) продуктов по свежему сырью составит, %:
СГАЗ =3 • 4,25 = 12,75
СБЕНЗ = 2 • 17,73 = 53,19
СОСТ = 3 • 11,35 = 34,05
Отсюда количество получаемых продуктов, т/сут:
газ: 470 • 12,75/100 = 60
бензин: 470 • 53,19/100 = 250
остаток: 470*34,05/100 = 168
Таблица 4.3
Материальный баланс
| № | Приход | № | Расход | ||
| статья | т/сут | статья | т/сут | ||
| газойль | газ | ||||
| бензин | |||||
| остаток | |||||
| Всего | Всего |
Производительность печи: Gп =KR*G0=3* 470=1410 т/сут.
Из приведенных примеров следует, что результаты балансов позволяют рассчитать: расходные коэффициенты, состав и количество получаемых продуктов реакций, выход продуктов, селективность, материальные и энергетические потери или, в конечном счете, степень использования сырья и энергии, характеризуемую энергетическим коэффициентом (энергетический к.п.д.), который равен: n= Qпол/Qполн (4.14)
где Qпол - полезно затрачиваемая теплота, например на осуществление целевой реакции; Qполн - суммарный расход теплоты.
В приведенном выше примере теплового баланса окисления аммиака (табл.2) полезно используемой является теплота, идущая на производство пара. Следовательно, в этом случае энергетический к.п.д. составляет: n=890/1233,7*100=78,14%
Однако энергетический к.п.д. получаемый из энтальпийного баланса, не достаточен для оценки эффективности процесса, поскольку он не всегда вскрывает потенциальные возможности системы.
4.4. ОСНОВНЫЕ ПОНЯТИЯ ЭКСЕРГЕТИЧЕСКОГО АНАЛИЗА ХТС
Информацию, позволяющую более полно обосновать выбор процесса и провести его сравнение с другими, можно получить при применении наряду с энтальпийным, термодинамического анализа, в частности эксергетического.
Эксергия характеризует полезную работу, которую может совершить система в соответствии со вторым законом термодинамики, согласно которому не все процессы могут протекать в направлении, обратном его естественному ходу. Эксергия - это энергия, которая при участии заданной окружающей среды, может быть преобразована в другую форму энергии. Использование эксергии дает возможность при оценке исравнении эффективности различных процессов учесть не только количество потоков энергия, но и их качество, т.е. способность энергии к совершению полезной работы. Удельная эксергия потока вещества, исходя из второго закона термодинамика, будет:
е= H - H0 - T0(S-S0) (4.15)
где H, S - энтальпия и энтропия вещества в анализируемом состоянии соответственно; H0, S0- энтальпия и энтропия вещества в состоянии термодинамического равновесия с окружающей средой, соответственно; T0 - температура окружающей среды.
Из уравнения (4.15) следует, что величина эксергии находится с помощью известных параметров состояния - энтальпии и энтропии. При этом потери эксергии в адиабатной системе определяются произведением температуры окружающей среды на приращение энтропии вследствие необратимости процесса. Они будут равны:
Δе = T0(S-S0) (4.16)
В качестве примера можно принять теплопередачу и установить для этого процесса зависимость потери эксергии от температуры. Предположим, что теплый поток А передает тепловую энергию холодному потоку В. Количество передаваемой теплоты для элементарного участка теплообменника будет d Q. Из уравнения (4.16) учитывая, что S=Q/T, следует, поток А с количеством теплоты d Q передает поток эксергии, равный
deA=(1-T0/TA)* d Q (4.17)
Холодный поток получает только часть этой величины
d eB=(1-T0/TB)* d Q (4.18)
Разница, или потеря эксергии составит:
de= deA- deB=T0* d Q*(1/TB-1/TA) (4.19)
или de= deA- deB=T0* d Q*((TA -TB )/TB*TA) (4.20)
Уравнение (4.20) показывает, что потеря эксергии зависит не только от конечной разности температур, но так же от температурного уровня теплопередачи. Весьма интересно, что потери эксергии при той же разности температур при высокой температуре много меньше, чем при низкой. Поэтому, с энергетической точки зрения, выгодно вести процессы при высоких температурах, так как в этом случае допустимы значительно большие разности температур, чем при температурах низких.
Критерием термодинамической эффективности процесса служит эксергетический коэффициент полезного действия, который в общем виде может быть представлен как:
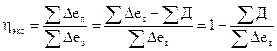 (4.21)
(4.21)
где ΣΔeп- произведенная эксергия, ΣΔe3- затраченная эксергия; ΣД - потеря эксергии.
Значения эксергетического и энергетического к.п.д., как правило, не совпадают. Так, например, энтальпийный анализ показал, что энергетический к.п.д. узла окисления аммиака в производстве азотной кислоты составляет 72,14%. Для этого же процесса эксеpгeтический к.п.д. рассчитанный по уравнению (4.21) составил 51,9 %.
Таким образом, проведенный эксергетический анализ свидетельствует, что для интенсификации процесса имеются ресурсы большие, чем это следует из анализа энтальпического. Следовательно, эксергетический анализ дает возможность оценки совершенства процессов и показывает границы их улучшения.
Полученные в результате анализа ХТС сведения о материальных и тепловых нагрузках аппаратов системы, эффективности их использования позволяют количественно оценить различные варианты и подойти к созданию систем, в которых наилучшим образом одновременно используется сырье, оборудование и энергия.
В настоящее время наиболее эффективно решается проблема использования энергии в энерготехнологических системах, для которых характерна строгая сбалансированность производства и потребления энергии, основанная на использовании теплоты экзотермических реакций и вторичных энергетических ресурсов.
Дата добавления: 2015-08-20; просмотров: 244 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ЗАДАЧИ, РЕШАЕМЫЕ ПРИ ПРОЕКТИРОВАНИИ ХТС. | | | Основные МЕТОДЫ расчета ХТС. |