
Читайте также:
|
| № п/п | 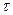 , мин. , мин.
| 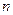 , см3 , см3
| 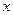 ,
моль/ дм3 ,
моль/ дм3
| 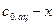
| 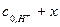
| 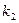
|
| ~ 1 | ||||||
| 2 и т.д. | ||||||
| · · · и т.д. |
8. Вторую пробу взять через 5 мин от начала опыта, последующие - через каждые 10 мин. Всего взять 8-10 проб, всякий раз титруя их раствором гипосульфита натрия в присутствии крахмала для определения концентрации йода.
9. Рассчитать убыль концентрации йода по формуле 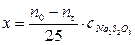 , где
, где 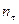 - данные из таблицы;
- данные из таблицы; 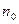 - объем раствора гипосульфита натрия, который должен был пойти на титрование в момент начала реакции (замерить его экспериментально невозможно, поэтому находят из графика
- объем раствора гипосульфита натрия, который должен был пойти на титрование в момент начала реакции (замерить его экспериментально невозможно, поэтому находят из графика  экстраполяцией на ординату при
экстраполяцией на ординату при 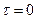 ).
).
10. Заполняя последующие колонки рабочей таблицы, нужно помнить, что начальные концентрации ионов водорода  и ионов ацетона
и ионов ацетона 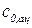 определяются с учетом разведения по формуле (9).
определяются с учетом разведения по формуле (9).
11. Вычислить 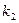 по уравнению (34) и
по уравнению (34) и 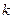 по уравнению (32). Построить график зависимости
по уравнению (32). Построить график зависимости  , где
, где 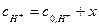 .
.
12. Рассчитать скорость реакции по уравнению (33) и построить график, показывающий её изменение во времени.
13. Построить график зависимости  , где
, где  . Определить скорость процесса в 3-4 точках дифференциально - графическим методом (методом касательных). Полученные значения скорости нанести на график
. Определить скорость процесса в 3-4 точках дифференциально - графическим методом (методом касательных). Полученные значения скорости нанести на график  , построенный по п. 12, и оценить величину отклонений.
, построенный по п. 12, и оценить величину отклонений.
Контрольные вопросы
1. Основные представления о механизме каталитической реакции.
2. Понятие о лимитирующей стадии гомогенной химической реакции
3. Формы каталитического воздействия на реакционный процесс.
4. Способы изучения кинетических особенностей каталитических реакций.
5. Кинетические особенности автокаталитических реакций.
6. Кинетические особенности исследуемой реакции.
7. Определение кинетических параметров автокаталитической реакции.
8. Математическая оценка погрешности химического эксперимента.
Работа 8. Определение константы скорости
Дата добавления: 2015-08-10; просмотров: 38 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Не следует забывать, что делать это нужно перед каждым титрованием | | | Гетерогенной реакции |