
Читайте также:
|
| Объемы растворов, см3 | 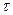 ,
с ,
с
| 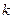 ,
с-1 ,
с-1
| |||||||
| Малый стакан | Большой стакан | ||||||||
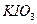
| 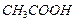
| 
| Во- да | 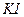
| 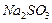
| Во-да | крахмал | ||
3. Повторить то же самое, изменяя объемы растворов в соответствии со второй, третьей и четвертой строками таблицы, всякий раз записывая показания секундомера в момент посинения раствора.
4. Считая первый опыт стандартным, определить частные порядки реакции относительно ионов  ,
,  и
и  , суммированием найти общий порядок реакции. Для определения частных порядков необходимо сравнивать время протекания реакции. Двукратное увеличение концентрации того или иного компонента приводит к сокращению времени реакции, при этом уменьшение времени реакции в два раза свидетельствует о первом порядке по данному компоненту, а уменьшение времени в четыре раза – о втором порядке.
, суммированием найти общий порядок реакции. Для определения частных порядков необходимо сравнивать время протекания реакции. Двукратное увеличение концентрации того или иного компонента приводит к сокращению времени реакции, при этом уменьшение времени реакции в два раза свидетельствует о первом порядке по данному компоненту, а уменьшение времени в четыре раза – о втором порядке.
5. Рассчитать константу скорости реакции для всех случаев по уравнению (31). При расчете ионных концентраций необходимо учитывать разведение растворов по формуле (10), не забывая, что общее количества раствора получилось равным 200 см3. Концентрацию ионов водорода вычислять по формуле буферной смеси (см. ниже пример расчета).
6. По уравнению (3) определить среднее значение константы скорость реакции 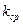 .
.
7. Дать оценку погрешности опытов, используя критерий Стьюдента.
Пример расчета ионных концентраций
Для первого опыта концентрации ионов будут равны:
для иона 
 ;
;
для иона 
 ;
;
для иона 
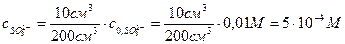 ,
,
для иона 
 .
.
Контрольные вопросы
1. Основные представления о механизме химических реакций.
2. Понятие о молекулярности реакции, о частном и общем порядках химической реакции.
3. Методы определения порядка реакции.
4. Определение порядка реакции по изменению относительного количества реагента.
5. Исследование кинетических закономерностей химических реакций физическими и химическими методами.
6. Кинетические особенности исследуемой реакции.
7. Интегральные способы расчета константы скорости реакции по опытным данным.
8. Способы определения погрешности эксперимента.
Работа 5. Изучение зависимости скорости химической реакции
Дата добавления: 2015-08-10; просмотров: 39 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Порядок выполнения работы | | | От температуры |