
Читайте также:
|
Цель работы: ознакомление с закономерностями протекания гомогенных реакций и одним из методов определения частных и общего порядков реакции.
Исследуемая реакция протекает по уравнению
 . ………………...(а)
. ………………...(а)
Выделяющийся йод мгновенно вступает во взаимодействие
 . (б)
. (б)
Кроме того, в смеси протекает медленная реакция, практически не влияющая на исследуемую реакцию
 .
.
Скорость реакции (а) можно выразить уравнением  ,
,
где 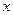 ,
,  и
и  - частные порядки реакции.
- частные порядки реакции.
Общий порядок реакции равен  .
.
Для контроля скорости изучаемого взаимодействия удобна сопровождающаяся посинением реакция (б), по ней скорость равна:  .
.
Очевидно, что
 =
=  .
.
Поэтому для константы скорости реакции можно записать соотношение
 . (31)
. (31)
Если изменять последовательно относительные количества  ,
, 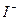 и
и  , сохраняя концентрации оставшихся двух видов ионов постоянными, то скорость изучаемой реакции будет изменяться в том же соотношении, в каком изменяется концентрация в соответствии с кинетическим уравнением (с учетом показателя степени).
, сохраняя концентрации оставшихся двух видов ионов постоянными, то скорость изучаемой реакции будет изменяться в том же соотношении, в каком изменяется концентрация в соответствии с кинетическим уравнением (с учетом показателя степени).
Приборы и материалы: секундомер, 2 химических стакана, мерный цилиндр на 100 см3 для дистиллированной воды, пипетки на 20, 10 и 5 см3. Растворы: 0,05М 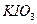 ; 0,5М
; 0,5М 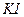 ; 0,01М
; 0,01М 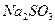 ; 0,5М
; 0,5М 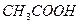 ; 0,05 М
; 0,05 М 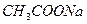 , крахмал.
, крахмал.
Дата добавления: 2015-08-10; просмотров: 49 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Порядок выполнения работы | | | Порядок выполнения работы |