
Читайте также:
|
1. В способе подстановок подставляют зависимости концентраций от времени в выражение константы реакции предполагаемых порядков. Выбирают уравнение, по которому значение вычисленной константы близко к постоянному значению.
2. В графическом способе изображают зависимости lnc, 1/c или 1/c2 от времени при одинаковых начальных концентрациях c0 всех реагентов. Если зависимости линейны, то реакции описываются уравнениями приведенными выше.
3. По времени tx, для которого cx = c0 · x (здесь непрореагировавшая часть x<1). При одинаковых начальных концентрациях c0 всех реагентов:
tx = c01-n(x1-n – 1) / (n-1) · k = A · c01-n (1)
lntx = lnA + (1-n) · ln c0 (2)
 (3)
(3)
Это уравнение (3) приложимо к реакциям первого порядка. У таких реакций  .
.
4. По скорости в начале реакции. Строят графики зависимости концентрации от времени и построением касательных к 2-3 кривым в один и тот же момент времени определяют скорость реакции при одинаковых начальных концентрациях всех реагентов.
Пусть  и
и  . Делением одного выражения скорости на другое исключают константу скорости и после логарифмирования полученного отношения находят n и далее k. Этот способ дает суммарный порядок по всем компонентам.
. Делением одного выражения скорости на другое исключают константу скорости и после логарифмирования полученного отношения находят n и далее k. Этот способ дает суммарный порядок по всем компонентам.
5. По относительным концентрациям реагентов. Способ по смыслу такой же, что и (4). Только расчеты производят непосредственно с относительными концентрациями ri = ci / c0.
Константы скорости для реакций первого, второго и третьего порядка
Для элементарной реакции (или стадии) первого порядка:
A → Продукты, (1)
или a1·A1 + a2·A2 →Продукты (2)
выражение для скорости реакции (при порядке по веществу А2 равном 0):
 (3)
(3)
Скорость элементарной реакции (1) связана со скоростью образования исходного вещества А соотношением:
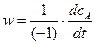 , (4)
, (4)
где (-1) – стехиометрический коэффициент исходного вещества А в уравнении (1).
Подставим (4) в (3):
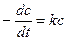 (5)
(5)
В общем виде скорость формально простой реакции (2) выглядит так:
 (6)
(6)
Подставим (6) в (3):
 , где k`=a1k (7)
, где k`=a1k (7)
Разделив переменные, получим
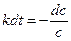 (8)
(8)
Проинтегрируем выражение в пределах 0 – t и c0 – c:
 ,
, 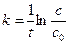 , c = c0е-kt (9)
, c = c0е-kt (9)
где с0 – начальная концентрация исходного вещества А;
с – концентрация вещества А к моменту времени t.
Константа скорости реакции 1-го порядка имеет размерность (время)-1
Пример: с-1, мин-1, с-1.
Время полураспада или полупревращения t1/2 равно промежутку времени, в течение которого реагирует половина взятого количества вещества.
Из уравнения (9) при с = ½ с0
 (10)
(10)
Таким образом, t1/2 для реакций 1-го порядка не зависит от количества и концентрации исходного вещества и обратно пропорционально скорости реакции.
Степень превращения α – доля распавшегося вещества
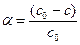 (11)
(11)
(для реакций 1-го порядка не зависит от начального количества вещества)
Выражение для k можно записать также в виде:
 , (12)
, (12)
где a = с0 · V – начальное количество вещества
a – x = c · V – количество вещества, которое осталось во всем объеме V к моменту времени t.
х – количество прореагировавшего вещества.
Для элементарной реакции (или стадии) второго порядка:
2A → Продукты (1)
1 случай – реагируют две одинаковые частицы
a1·A1 + a2·A2 →Продукты (2)
предположим, что по веществу А2 порядок равен 0.
Тогда  (3)
(3)
 (4)
(4)
Подставим (4) в (3) и получим:
 , где k=2k` (5)
, где k=2k` (5)
Для реакции (2) будет:
 (6)
(6)
и соответственно
 , где k=a1k` (7)
, где k=a1k` (7)
Проинтегрируем и получим:
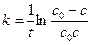 (8)
(8)
Размерность константы скорости реакции II-го порядка
(концентрация)-1 · (время)-1
Пример: л/(моль·с)
Время полураспада  (9)
(9)
Таким образом, t1/2 обратно пропорционально начальной концентрации исходного вещества.
2 случай – реагируют две различные частицы.
A1 +·A2 →Продукты (10)
 (11)
(11)
 (12)
(12)
 (13)
(13)
Учитывая, что с1 = с10 – х и с2 = с20 – х уравнение (13) примет вид:
 (14)
(14)
где с10 и с20 – начальные концентрации А1 и А2
х – уменьшение концентрации А1 или А2 к моменту времени t.
 (15)
(15)
Разделим переменные и проинтегрируем:
 (16)
(16)
Выразим k через степень превращения α:
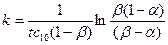 (17)
(17)
где x = c10 · α и β = с20 / с10
Для элементарной реакции третьего порядка:
3А → Продукты (1)
или A1 +·A2 +А3 →Продукты (2)
1 случай – с1=с2=с3=с в любой момент t:
 (3)
(3)
 (4)
(4)
Отсюда  и k = 3k` (5)
и k = 3k` (5)
Для реакции (2) имеем:
 (6)
(6)
Отсюда  и k = k` (7)
и k = k` (7)
Разделим переменные в (5) и (7):
 (8)
(8)
Проинтегрируем в интервале 0 - t и с0 - с и получим:
 (9)
(9)
 (10)
(10)
Таким образом, t1/2 для реакции III-го порядка обратно пропорционально квадрату начальной концентрации исходных веществ.
Размерность (время)-1 · (концентрация)-2
Пример: л2/(моль2 · с)
2 случай – для реакции A1 +·2A2 →Продукты (11)
или 2 A1 +·A2 →Продукты (12)
при с10=с20=с0
Для (11) 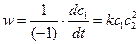 (13)
(13)
или  (14)
(14)
Для (12)  (15)
(15)
или  (16)
(16)
где х – уменьшение концентрации вещества А1.
3 случай – для реакции (2) при разных концентрациях веществ А1, А2 и А3:
 (17)
(17)
или 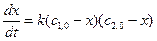 (18)
(18)
Кинетика сложных реакций
Большинство реакций являются сложными и состоят из нескольких элементарных стадий.


 Основные типы
Основные типы
обратимые (двусторонние) параллельные последовательные
Рассмотрение сложных реакций упрощается, если реакции протекают в стационарных или квазистационарных условиях и имеется лимитирующая стадия. Элементарная стадия называется лимитирующей, когда закономерности всего процесса определяются в основном кинетическими закономерностями этой стадии (другими словами, самая медленная стадия, которая определяет процесс в целом).
Рассмотрим формальную кинетику для сложных гомогенных реакций в закрытых системах.
1. Двусторонние (обратимые) реакции
k+
А↔B (1)
k-
где k+ и k- - константы скорости прямой и обратной элементарной стадии
w = w+ - w- = k+ · c1 – k- · c2 (2)
где с1 и с2 – концентрации А и В в момент времени t/
 Учитывая, что с1 = с10 – х,
Учитывая, что с1 = с10 – х,
с2 = с20 + х (3)

Получим 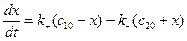 (4)
(4)
Где с10 и с20 – концентрации А и В при t =0.
В состоянии равновесия w+ = w- и  (5)
(5)
Заметим, что при наличии двух последовательных двусторонних стадий это положение не очевидно, так как
w1 w2
в случае (а) А↔В↔С (6)
w-1 w-2
кроме условия равновесия w+ = w-=w2 - w-2 можно представить и другие условия. Например, циклическое протекание реакции:





 B В
B В
w1 w-1 w-2 w2 или
w3

 A C А С
A C А С
w-3
(б) (в)
Для (б) условие равновесия:
w1 – w-1 = w2 – w-2 = w3 – w-3# 0
Для (в) w1 = w2 = w3 # 0
Принцип детального равновесия. При равновесии в химической реакции любая элементарная стадия протекает с одинаковой скоростью как слева направо, так и справа налево.
Таким образом, обратная реакция в тех же условиях обязательно протекает через те же стадии.
w-1 w-2
Отсюда можем записать С↔В↔А (7)
w1 w2
В состоянии равновесия
 (8)
(8)
где хр – изменение концентрации, которое находят из опыта через достаточно большой промежуток времени после начала реакции, когда система достигает почти равновесного состояния.
 (9)
(9)
где К – константа равновесия.
Таким образом,
 (10)
(10)
2. Параллельные реакции
Когда взятое для реакции вещество претерпевает одновременное изменение в двух направлениях и более.
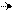
 k1 В
k1 В
 А (1)
А (1)
 k2 Д
k2 Д
Общая скорость образования вещества А:
 (2)
(2)
где с1 – концентрация вещества А.
Разделим переменные и проинтегрируем:
c1 = c10 · е-(k1+k2)t (3)
Скорость получения В и Д равна:
 и
и 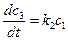 (4)
(4)
где с2 и с3 – концентрации В и Д.
Подставим (3) в (4) и получим:
 dc2 = k1c10е-(k1+k2)tdt (5)
dc2 = k1c10е-(k1+k2)tdt (5)
dc3 = k2c10e-(k1+k2)tdt
Проинтегрируем в пределах 0 – с2 и 0 – с3:
 (6)
(6)

3. Последовательные реакции
Промежуточные вещества, которые образуются в одной стадии, расходуются в последующей.
k1 k2
А→P→B (1)
k1
или A→P, w1 = k1 · c1
k2
P→B, w2 = k2 · c2 (2)
где Р – промежуточное соединение.
Обозначим концентрации А, В и Р через с1, с2 и с3.
1 случай. Скорости обеих реакций примерно одинаковы.

Следовательно, c1 = c10 · е-k1t (3)
где с10 – начальная концентрация вещества А.
Скорость образования Р в первой и второй стадиях:
w1 = k1c1 и w2 = k2c2 (4)
Суммарная скорость образования Р
w = w1 + w2
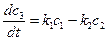 (5)
(5)
Подставим с1 из (3) в (5)
 (6)
(6)
После ряда математических преобразований получим выражение для с3:
 (7)
(7)
Теперь найдем с2:
т.к.  (8)
(8)
то после математических преобразований получим:
 (9)
(9)
k1 k2
2 случай. A→P↔B (1)
k-2
Считаем, что 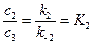 (2)
(2)
с1 = с10е-k1t (3)
 (4)
(4)
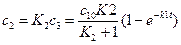 (5)
(5)
k1 k2
3 случай. A↔P→B (1)
k-1
Считаем, что  (2)
(2)
с1 = с10е-k2t (3)
 (4)
(4)
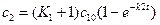 (5)
(5)
4. Сопряженные реакции
По Шилову Н.А. – когда самопроизвольно идущая в системе реакция вызывает протекание другой реакции, не осуществимой в отсутствии первой – химическая индукция.
Две реакции, одна из которых индуцирует протекание другой, называются сопряженными.
Пример: А + В → М

 A + B + C → M + N (1)
A + B + C → M + N (1)
А + С → N
Вещество В вызывает реакцию А и С. Вещество А – актор, В – индуктор, С – акцептор.
Фактор индукции Ф – количественная характеристика эффективности химической индукции – отношение скорости расходования акцептора на скорость расходования индуктора.
5. Автокаталитические реакции.
Реакция называется автокаталитической, если она ускоряется одним из продуктов реакции.
Рассмотрим автокаталитическую реакцию, идущую в две стадии.
k1
А + В → D – лимитирующая стадия
D → 2В – быстрая стадия (1)
А → В – суммарная реакция
где А – исходное вещество
D – промежуточное состояние
B – продукт – катализатор
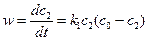 (2)
(2)
с2 – концентрация В в момент t
с1 = с0 – с2 – концентрация А в момент t
с0 = с10 + с20 = с1 + с2 (3)
где с0 – сумма начальных концентраций веществ А и В.
 w
w
 |
 c2max c2
c2max c2
c2
c0
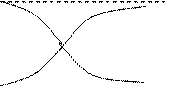 |
 t1/2 t
t1/2 t
 w
w
wmax
 |
 tmax t
tmax t
Рис. Зависимости от времени: 1 – скорости автокаталитической реакции; 2 – концентрации исходного вещества; 3 - 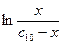
Дата добавления: 2015-08-10; просмотров: 65 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Для которой | | | Зависимость скорости химической реакции от температуры |