
Читайте также:
|
Скорость химической реакции сильно зависит от температуры.
Правило Вант-Гоффа: для реакций, протекающих при обычных температурах (273-373 К), увеличение температуры на 10 К вызывает, как правило, увеличение скорости реакции в 3-4 раза.
Уравнение Аррениуса. 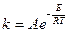 (1)
(1)
где А – предэкспоненциальный множитель
Е – энергия активации.
Энергия активации, как правило, не зависит от температуры.
Энергия активации приближенно равна превышению средней энергии активированного комплекса над средним уровнем энергии исходных веществ.
Другими словами, энергия активации – это минимальная энергия, необходимая для осуществления элементарного акта химического взаимодействия.
Е1 – Е2 = ∆H (2)
где Е1 и Е2 – энергия активации прямой и обратной реакции
∆H – тепловой эффект реакции
При ∆H > 0 Е1 > Е2 эндотермическая реакция
При ∆H < 0 Е1 < Е2 экзотермическая реакция
Предэкспоненциальный множитель А практически не зависит от температуры.
Уравнение Аррениуса справедливо только для элементарных реакций.
 Е Е
E2
координата реакции эндотермическая реакция |
 Е Е
E1
координата реакции экзотермическая реакция |
Прологарифмируем (1):
ln k = ln A – Е1/RT (3)
ln k 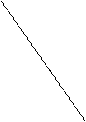

 α
α

1/Т
Рис. Аррениусовская зависимость ln k от 1/Т
Е = R·tgα
lnA = lnk + E/RT (4)
w = kc
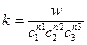 (5)
(5)
где n – порядок реакции.
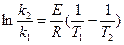 (6)
(6)
Отсюда 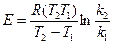 (7)
(7)
Теория активных столкновений (соударений)
Теория активных столкновений (С. Аррениус) основана на том, что химическое взаимодействие осуществляется только при столкновении активных частиц, которые обладают достаточной энергией для преодоления потенциального барьера реакции и ориентированы в пространстве друг относительно друга.
Чтобы произошла реакция, частицы в момент столкновения должны обладать некоторым минимальным избытком энергии, называемым энергией активации (см. выше).
Здесь молекулы рассматриваются, как бесструктурные частицы.
Доля активных молекул от 10-20 до 10-10. Если меньше – скорость мала, если больше – практически мгновенна.
Дана элементарная бимолекулярная реакция
А + В → Продукты (1)
Молекула А – неподвижная, В – движутся в пространстве параллельно прямой, проходящей через центр А.
Согласно молекулярно-кинетической теории газов полное число столкновений L0 за 1с в 1м3 между одинаковыми молекулами рассчитывается по формуле
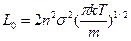 (2)
(2)
где L0 – общее число столкновений
n – число молекул в 1м3
m – масса частиц, кг
Если частицы разные, то
 (3)
(3)
где 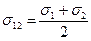 - диаметр молекулы
- диаметр молекулы
Число столкновений активных молекул La,рассчитанное на основе закона распределения Максвелла-Больцмана, определяется соотношением:
La = L0 · e-Ea/RT (4)
Скорость w = kc1c2 (5)
c1 = n1/NA и c2 = n2/NA
где n1 и n2 – число частиц А и В в 1м3.
Число активных столкновений
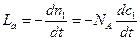 (6)
(6)
При этом 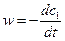 (7)
(7)
Используя (4) и (5) получим
 (8)
(8)
Подставив (8) в (5) с учетом с1 и с2:
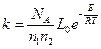 (9)
(9)
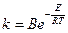 , где
, где  (10)
(10)
Введем еще один множитель Р (стерический или энтропийный фактор), учитывающий отклонение теоретических расчетов от опытных данных.
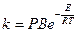 (11)
(11)
Недостатки метода:
1. не объясняет влияния на скорость реакции растворителя, давления, добавок инертных газов и др. факторов.
2. не позволяет сделать теоретическую оценку стерического фактора.
Теория активированного комплекса или активированного состояния
Основана на том, что элементарный акт взаимодействия молекул состоит в перестройке химических связей, при котором начальная конфигурация атомов в исходных молекулах переходит в конечную у продуктов реакции при непрерывном изменении межатомных расстояний.
Вспомним, что такое активированный комплекс. В ходе химического превращения достигается некоторое промежуточное состояние – переходное состояние, когда одни связи растянулись, но еще не разорвались, а новые только еще образуются. Это промежуточное образование – активированный комплекс.
 Епот.
Епот.
 [J…H…H]
[J…H…H]
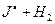
 A
A

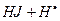
B
 |
координата реакции
Активированный комплекс (АК) в переходном состоянии находится на вершине потенциального барьера, поэтому не устойчив.
Таким образом, теорией активированного комплекса или переходного состояния называют качественные представления об элементарном акте как о сложном процессе перестройки химических связей при сближении молекул, а также представления о поверхности потенциальной энергии и координате реакции.
Координата реакции – путь реакции, например, расстояние между двумя атомами водорода.
Среднее время жизни АК равно:
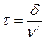 (1)
(1)
где δ – некоторый интервал вдоль пути реакции, включающий вершину потенциального барьера Р.
ν/ - средняя скорость прохождения АК вершины потенциального барьера Р.
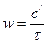 (2)
(2)
с/ - концентрация АК в 1м3 газа.
 (3)
(3)
χ – трансмиссионный коэффициент – равен доле АК, скатывающихся с перевала Р в долину Р2 и распадающихся при этом на конечные продукты.
(1 – χ) – доля АК, скатывающихся обратно в долину Р1, распадаясь на исходные вещества.
Для реакции А + В → [AB] → Продукты (4)
w = kcAcB (5)
Подставим (3) в (5)
 (6)
(6)
А также запишем выражения для АК через термодинамические функции
 (7)
(7)
 - изменение энергии Гиббса при образовании АК из исходных веществ в стандартном состоянии.
- изменение энергии Гиббса при образовании АК из исходных веществ в стандартном состоянии.
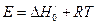 (8)
(8)
Цепные и фотохимические реакции
Цепными называются химические реакции, в которых пояаление активной частицы вызывает большое число превращений неактивных молекул вследствие регенерации активной частицы в каждом элементарном акте химической реакции.
Активные частицы – свободные атомы, ионы, радикалы и возбужденные молекулы.
Свободные радикалы – частицы, содержащие хотя бы один неспаренный электрон и поэтому обладающие ненасыщенными валентностями (R•).
Стадии цепных реакций:
1. зарождение цепи – образование свободных радикалов.
2. рост цепи определяется длиной цепи. Длина цепи – число молекул данного исходного вещества, которые прореагировали в результате одного элементарного акта зарождения цепи.
3. обрыв цепи – процесс, в результате которого активные частицы или исчезают или дезактивируются.
Рассмотрим на примере образования HCl:
Cl2 → 2Cl•
H2 + Cl• → HCl + H•
H• + Cl2 → HCl + Cl•
H• + Cl• → HCl
Cl• + стенка → Cl (адсорбирован)
Фотохимические реакции – идут при воздействии света на вещество (фотолиз).
I закон фотохимии – Гротгус и Дрепер – только поглощаемое средой излучение может произвести ее химическое превращение.
II закон фотохимии – Эйнштейн и Штарк – каждый поглощенный квант света в первичном акте способен активировать только одну молекулу.
Топохимические реакции
гетерогенные реакции, в которых участвует по крайней мере одно твердое исходное вещество и один твердый продукт реакции. Они локализованы между твердым исходным веществом и твердым продуктом химического превращения (в зоне реакции).
Дата добавления: 2015-08-10; просмотров: 55 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Способы определения порядка реакции | | | Сутність та складові економічної безпеки малого та середнього бізнесу |