
Читайте также:
|
w(А)=(-1)w(1) + (+1)w(-1) = -w1 + w-1 (8)
w(В)=(+1)w(2) + (-1)w(-2) = w2 - w-2 (9)
w(Р)=(+1)w(1) + (-1)w(-1) +(-1)w(2) + (-1)w(-2) (10)
Зависимость скорости реакции от концентрации реагентов.
Закон действующих масс.
Дана элементарная бимолекулярная реакция в закрытой системе:
1) A + B → Продукты (1)
 (2)
(2)
где k – константа скорости
2) 2A → Продукты (3)
 (4)
(4)
Закон действующих масс – скорость бимолекулярных элементарных реакций пропорциональна произведенипю концентраций реагентов в степени, равной абсолютномц значению их стехиометрических коэффициентов в уравнении реакции.
То есть для любой элементарной реакции
a1·A1 + a2·A2+a3·A3 →Продукты (5)
где a1, a2, a3 – стехиометрические коэффициенты
 (6)
(6)
Показатели степени a1, a2, a3 в (5) называют порядками реакции по веществам A1, A2, A3.
a = a1 + a2 + a3 = ∑iai (7)
это общий или суммарный порядок реакции.
Зависимость скорости реакции от концентрации называется кинетическим уравнением.
a = 1 A → Продукты, 
a = 2 A1 + A2 → Продукты, 
2A → Продукты, 
a = 3 A1 + A2 +A3 → Продукты, 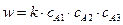
2A1 + A2 → Продукты, 
3A → Продукты, 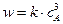
Дата добавления: 2015-08-10; просмотров: 31 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Так как , то | | | Способы определения порядка реакции |