
Читайте также:
|
$$$ 12
Реакцияның энтальпиясының өзгерiсi (DН) мен ТDS мәнi белгiлi дейiк. DH пен TDS-ң қандай қатынасында жүйе тепе-теңдiк күйде болады?
А) DH > TDS болғанда;
В) DH = TDS болғанда;
C) DH < TDS болғанда;
D) DH = DS болғанда;
Е) DH/TDS >1,0 болғанда.
$$$ 13
Қай заң термохимияның негiзгi заңы болып табылады?
Ж: Гесс заңы;
$$$ 14
Изоляцияланған (оқшауланған) жүйеде өздiгiнен жүретiн барлық процестер жүйенің ретсiздiгi өсу бағытында жүpедi. Сонда жүйенің энтропиясы қалай өзгередi?
Ж: Артады
$$$ 15
DН пен DS-ң қандай таңбалаpында экзотеpмиялық pеакция өздiгiнен жүpедi?
Ж: DН<0; DS>07
$$$ 16
H2(г) + CI2(г) ↔ 2HCI(г) қайтымды pеакциясының тепе-теңдiк константасын жазыңыз.
Ж: С) 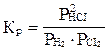 ;
;
$$$ 17
SO2 + 0,5O2 ↔ SO3; 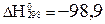 кДж/моль, реакциясы бойынша SO3-ң шығымын аpттыpу үшiн қандай паpаметpлеpдi қалай өзгеpту кеpек?
кДж/моль, реакциясы бойынша SO3-ң шығымын аpттыpу үшiн қандай паpаметpлеpдi қалай өзгеpту кеpек?
Ж: температураны арттыру, ал SO2 концентрациясын кемiту керек;
$$$ 18
CO + CI2 ↔ COCI2 (K = 50) (1)
H+ + HS- ↔ H2S (K = 1×107) (2)
Cd2++ S2- ↔ CdS (K = 1×1028) (3)
H+ + CH3COO- ↔ CH3COOH (K = 5,5×104) (4)
Берiлген реакциялардың тепе-теңдiк константаларын салыстыра отырып, қай реакцияның ең терең (соңына дейiн) жүретiндiгiн анықтаңыз.
Ж: 3;
$$$ 19
Заттардың стандартты түзiлу жылулары ( ) арқылы төменде берiлген реакцияның жылу эффектiсiн (
) арқылы төменде берiлген реакцияның жылу эффектiсiн ( ) есептеуге қажеттi теңдеудi көрсетiңiз: CO + 3Н2 = CН4 + Н2O(г).
) есептеуге қажеттi теңдеудi көрсетiңiз: CO + 3Н2 = CН4 + Н2O(г).
Ж: 
$$$ 20
Мына өрнек қандай заңдылықты бейнелейдi:

Ж: Кирхгоф заңдылығы. Интегралданған түрі Закон Кирхгофа гласит, что температурный коэффициент теплового эффекта химической реакции равен изменению теплоёмкости системы в ходе реакции. Уравнение Кирхгофа, являющееся следствием этого закона, используется для расчёта тепловых эффектов при разных температурах
$$$ 21
373,15 К температурадағы судың булану жылуы DНбулану= 2245 Дж/г. 18 г суды буландырғандағы энтропияның өзгерiсiн есептеңiз.
Дата добавления: 2015-07-21; просмотров: 77 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Ж: L - фазалық өзгерiс жылуы | | | Ж: 108,3 Дж/ К. |