
Читайте также:
|
Мономерные молекулы HF существуют в газообразном фтороводороде лишь при высоких температурах, а в обычных условиях даже газообразный фтороводород представляет собой полимерные молекулы, образованные за счет водородных связей, например молекулы H6F6, имеющие циклическое строение. Жидкий фтороводород (HF)n состоит из ассоциированных молекул:

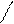

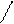

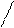 F F F
F F F
H H H H
Молекула фтороводорода образована ковалентной полярной связью.
QHF = 269 кДж/моль
2.2. Физические свойства фтороводорода: 
Ø Дымит на воздухе;
Ø Едкий газ с резким запахом;
Ø Хорошо растворим в воде;
Ø Его раствор представляет собой фтороводородную (плавиковую) кислоту средней силы;
Ø Сжижается при 19,50С;
Ø Удельный вес 0,987;
Ø Температура плавления -830С;
Ø Температура кипения 19,50С;
Ø Теплота образования 267,5 кДж.
Дата добавления: 2015-07-21; просмотров: 201 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Нахождение фтора в природе | | | Применение фтороводорода |