
|
Читайте также: |
3 главных молекулярных компонента

 соединительной ткани
соединительной ткани
 |
| Коллаген 25-39% от общего количества белка в организме или 6% от массы тела. (30%-глицин, 20%-про и оксипролин, 10%-аланин, 1%-гидроксилизин, 40%-др. аминокислоты). | Эластин Протеогликаны 30% глицин Белки (5%) + 21% аланин полисахариды (95%) 13% валин гликопротеины 10% лейцин 10% муцин |
Соединительная ткань в общей сложности составляет примерно 50% от массы всего тела. Соединительная ткань – это ткань подкожной клетчатки, сухожилий, связок, хрящей, а также органический матрикс костей и зубов, межмышечные фасциальные прослойки. Соединительная ткань окружает кровеносные сосуды, связывает между собой клетки отдельных тканей, заполняя пространство между клетками так называемым основным веществом (внутриорганная строма паренхиматозных органов, нейроглия мозга и т. д.).
Соединительная ткань состоит из трех главных элементов (см. схему).
1. Клетки соединительной ткани (фибробласты, хондроциты). По сравнению с другими тканями их мало. Поэтому межуточное вещество занимает больше места, чем клеточные элементы.
2. Коллагеновые, эластические и ретикулярные волокна, расположенные в окружении межуточного вещества.
3. Межуточное вещество (основное вещество), окружающее клетки и волокна соединительной ткани.
Существует три главных молекулярных компонента соединительной ткани: два фибриллярных белка – коллаген и эластин, которые в разных соотношениях присутствуют в большинстве видов соединительной ткани, и протеогликаны – молекулы, представляющие собой белки, ковалентно связанные с полисахаридами.
Коллаген – это основной белок коллагеновых волокон. Коллагеновые волокна - это морфологические образования, содержащие кроме белка коллагена и другие химические компоненты.
Коллаген имеет специфический аминокислотный состав: примерно 1/3 (33%) аминокислотных остатков приходится на глицин. Количество пролина в коллагене также значительно выше, чем в других белках. Наконец, в коллагене имеются две аминокислоты, которые крайне редко встречаются в других белках, а именно гидроксипролин и гидроксилизин:
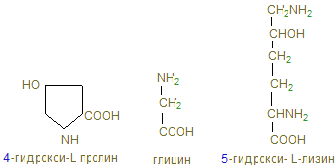
пролин и гидроксипролин составляют ¼ часть всех аминокислотных остатков и около 1% - гидроксилизин. В коллагене определенная последовательность аминокислот: почти каждый 3-й остаток – это глицин; часто повторяется участок глицин-пролин-гидроксипролин.
Основной структурной единицей коллагена является тропоколлаген, молекулярная масса которого составляет около 285000 Д. Тропоколлаген состоит из трех полипептидных цепей одинакового размера. Каждая полипептидная цепь тропоколлагена содержит около 1000 аминокислотных остатков, т.е. основная структурная единица коллагена – тропоколлаген имеет большие размеры, в частности, она в более чем в 10 раз больше химотрипсина.
Молекула тропоколлагена имеет форму стержня. Каждая из трех его полипептидных цепей имеет форму левозакрученной α-спирали. Кроме того, эти три спирализованные цепи закручиваются относительно друг друга, образуя тугую правозакрученную нить. Три полипептидные цепи связаны между собой водородными связями, возникающими, в основном, за счет водорода пептидных NH-группы глицина и кислородом пептидных С=О-групп аминокислотных остатков на других цепях.
Коллаген синтезируется клетками из свободных аминокислот. Однако, гидроксипролин и гидроксилизин не включаются в состав полипептидной цепи коллагена в процессе биосинтеза коллагена. Эти аминокислоты образуются с участием ферментов соответственно пролингидроксилазы и лизингидроксилазы, а также с участием аскорбиновой кислоты после включения пролина и лизина в полипептидную цепь. Указанные ферменты содержат в активном центре атом железа в фероформе (восстановленное состояние атома железе Fе2+). Аскорбиновая кислота выполняет роль восстановительного агента, сохраняя атом железа в фероформе. Остатки гидроксипролина придают структуре дополнительную стабильность за счет образования большого количества внутримолекулярных водородных связей (для этого используются окружающие молекулы воды). В отсутствие аскорбиновой кислоты коллаген оказывается негидроксилированным и поэтому не может образовать нормальные по структуре коллагеновые волокна, что приводит к поражению кожи и ломкости сосудов, столь четко выраженных при цинге.
Тропоколлаген, как это представлено на схеме, синтезируется фибробластами в виде проколлагена.
Полипептидные цепи проколлагена имеют дополнительные пептидные участки на концах полипептидных цепей (рис. Превращение проколлагена в тропоколлаген). Эти пептидные участки называются N-концевые и С-концевые пептиды.
Дата добавления: 2015-07-20; просмотров: 78 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Типы органической протеинурии | | | Схема формирования зрелого коллагенового волокна |