
Читайте также:
|
ОБУЧАЮЩИЕ ЗАДАЧИ И ЭТАЛОНЫ ИХ РЕШЕНИЯ
Для студентов 2 курса заочного отделения фармацевтического факультета
(IV семестр, летняя сессия)
II часть
VIII. Амины. Диазо-, азосоединения
Обучающая задача № 1.
Напишите химизм и механизм реакций лежащих в основе превращения норадреналина 2 – амино – 1- (3, 4 – дигидрокси – фенил) этанола в адреналин in vitro и далее получение лекарственного средства адреналина гидрохлорида. Объясните, почему растворы адреналина гидрохлорида рекомендуют хранить в защищенном от света месте. С кокой целью в инъекционные лекарственные формы адреналина гидрохлорида добавляют натрия метабисульфит? Какие свойства адреналина можно использовать для его идентификации?
Решение.
Общий подход.
В основе реакции превращения норадреналина в адреналин лежит реакция моноалкилирования.
Алкилирование – это реакция введения алкильной группы в молекулу органического соединения в результате взаимодействия нуклеофильного реакционного центра субстрата и электрофильной алкильной группы реагента.
В зависимости от характера нуклеофильного реакционного центра различают C–, N–, O–, S– Алкилирование. В качестве электрофильных реагентов используют галогеналканы, диалкилсульфаты, спирты. реакционная способность в реакции алкилирование зависит, в первую очередь от степени нуклеофильности реакционного центра, т.е. способности атома предоставить свою электронную пару на образование ковалентной связи с электрофильной частицей.
На степень нуклеофильности, как и на степень основности влияют следующие факторы:
1) электроотрицательность атома (для элементов одного периода) – чем выше электроотрицательность, тем меньше нуклеофильность;
2) поляризуемость атома (для элементов одной группы) – чем выше поляризуемость (больше размер атомного радиуса), тем больше нуклеофильность;
3) Электродонорные заместители увеличивают нуклеофильность;
4) электроотрицательные заместители уменьшают нуклеофильность;
5) сольватация понижает нуклеофильность;
В организме реакция алкилирования норадреналина проходит с участием фермента N – метилтрансферазы специфично с образованием N - монометильного производного адреналина.
В реакциях in vitro направление реакции определяется вышеизложенными факторами.
Этап 1. напишем структурные формулы норадреналина (1) и адреналина (2).
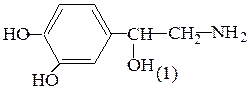
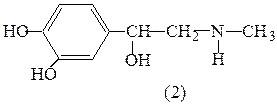
Определим нуклеофильные реакционные центры в молекуле норадреналина, сравним степень их нуклеофильности. В молекуле норадреналина имеется 3 группы нуклеофильных центров: 1) sp3 - гибридизированный атом азота; 2) sp3 - гибридизированный атом кислорода спиртовой гидроксильной группы; 3) два sp2 гибридизированных атома кислорода фенольных гидроксилов, электронные пары которых находятся в p-π – сопряжении с π – электронами бензольного кольца. Наименьшей нуклеофильностью обладают атомы кислорода фенольных гидроксилов вследствие электроотрицательного влияния бензольного кольца, проявляющего – М эффект. У более электроотрицательного sp3 - гибридизированного атома кислорода нуклеофильность меньше, чем у sp3 - гибридизированного атома азота.
Таким образом, в реакции с метилирующим реагентом должен участвовать атом азота как in vivo, так и in vitro. Однако реакция первичных аминов с галогеналканами in vitro проходит с образованием смеси вторичных, третичных аминов и солей четвертичных аммониевых оснований. Это объясняется большей нуклеофильностью образующихся аминов, конкурирующих с исходным амином при взаимодействии с электрофилным реагентом. Увеличение нуклеофильности вторичных и третичных аминов объясняется введением электродонорных алкильных радикалов.
Для получения моноалкильных производных, аминогруппу предварительно «защищают» ацилированием, по окончании алкилирования «защиту» снимают.
Этап 2. химизм реакции алкилирования без «защиты».
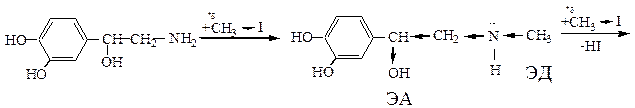
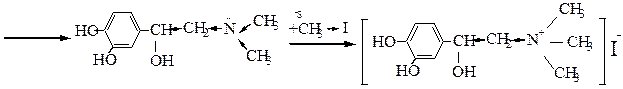
Этап 3. Химизм реакции моноалкилирования с «защитой» аминогруппы с использованием реакции ацилирования.
Ацилирование - реакция замещения атома водорода на ацил (кислотный остаток). Ацилирование аминов сопровождается образование амидов, которые легко гидролизуются с образованием исходных аминов и кислот (или их солей).
В качестве ацилирующих реагентов используются галогенангидриды кислот или ангидриды кислот.
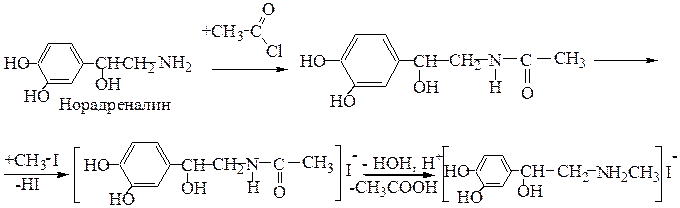
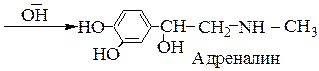
Этап 4. механизм реакции алкилирования норадреналина с использованием «защиты».
1. «Защита» аминогруппы, ацилирование. Реакция ацилирования проходит по механизму нуклеофильного присоединения с последующим элиминированием и образованием конечного продукта замещения SN(AN → E).
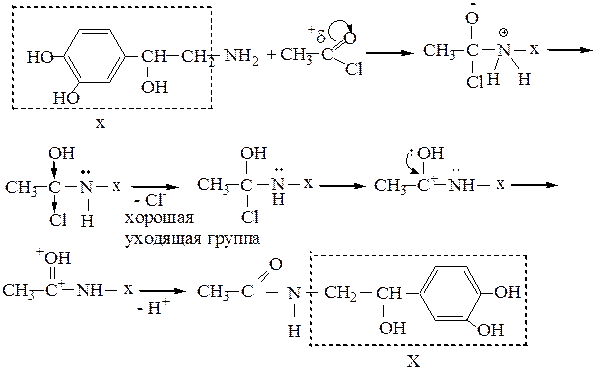
2. Алкилирование ацильного производного реакция первичных галогеналканов с нуклеофилами проходит по механизму SN2. Так как ацилированный амин обладает меньшей нуклеофильностью вследствие электроноакцепторного влияния карбонильной группы, для прохождения реакции алкилирования необходим достаточно реакционноспособный галоген – CH3I.
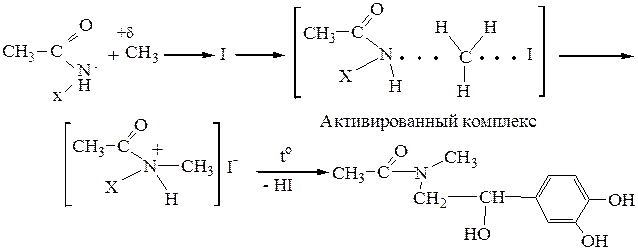
3. Снятие «защиты» кислотный гидролиз. Реакция протекает по тетраэдрическому механизму AAC2 (кислотнокатализируемая ацильная бимолекулярная реакция).
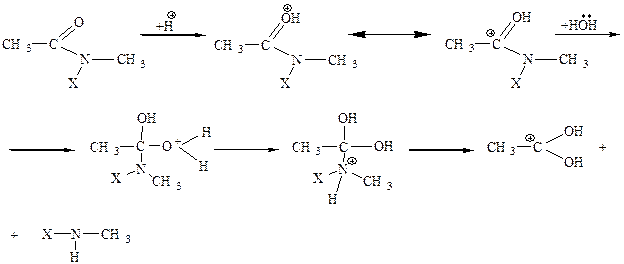
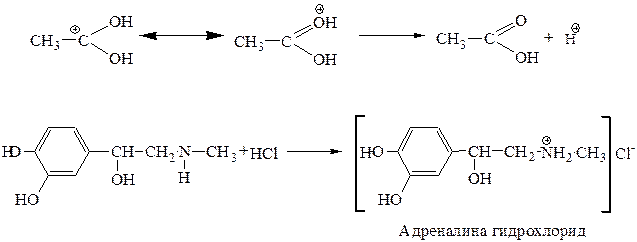
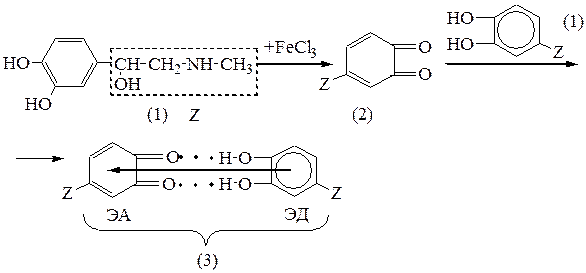
Этап 5. Адреналин является двухатомным фенолом с орто – расположением гидроксильных групп. Такие фенолы легко окисляются кислородом воздуха, FeCl3 и другими окислителями. Окисление кислородом воздуха проходит по радикальному механизму. Образование интермедиата – свободного радикала осуществляется в результате фотолиза. Поэтому с целью предохранения растворов адреналина гидрохлорида их рекомендуют хранить в защищенном от света месте, а для стабилизации используют в качестве восстановителя натрия метабисульфит.
Этап 6. для идентификации адреналина гидрохлорида можно использовать окислительно – восстановительную реакцию с FeCl3, в результате которой образуется комплекс с переносом заряда изумрудно – зеленого цвета (3). Реакция проходит поэтапно с образованием промежуточного о – хинона (2), который взаимодействует с избытком исходного фенола (1) с образованием комплекса (3) с переносом заряда от электронодонора фенола (П – избыточная система) к электроноакцептору (П - недостаточная система). Дополнительная стабилизация осуществляется за счет водородных связей. Комплексообразование вызывает батохромный сдвиг максимума поглощения электронного излучения, чем объясняется появление изумрудно - зеленого окрашивания.
Химизм реакции.
Заключение: 1) превращение норадреналина в адреналин in vitro можно осуществить N – монометилированием с предварительной «защитой» аминогруппы ацилированием и последующим снятием «защиты» реакцией кислотного гидролиза после оканчания алкилирования;
2) для стабилизации растворов адреналина гидрохлорида с целью предотвращения окисления кислородом воздуха их хранят в защищенном от света месте, в качестве стабилизатора используют натрия метабисульфит;
3) для идентификации можно использовать реакцию окисления адреналина гидрохлорида с помощью FeCl3.
Дата добавления: 2015-07-20; просмотров: 301 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химизм. | | | ЭТАЛОН ОТВЕТА Задача №1 |