
Читайте также:
|
Одним из наиболее широко используемых и информативных методов изучения границы раздела платиновых металлов с растворами электролитов является метод потенциодинамических кривых. Он состоит в наложении на электрод линейно изменяющегося во времени потенциала и измерении возникающего в цепи тока. Наиболее часто используют треугольную развертку потенциала, когда после достижения заданного значения Е направление изменения потенциала меняют на обратное. Если циклы треугольной развертки следуют непрерывно друг за другом, то такой метод измерения называют циклическим потенциодинамическим методом или методом циклической вольтамперометрии.
Так как при потенциодинамических измерениях dE/dt = const, то можно записать
E = EH + v*t,
где ЕН – начальный потенциал; v – скорость наложения потенциала. Таким образом, если в методе кривых заряжения I = const и E, t – кривая путем простого изменения единиц по оси абсцисс трансформируется в E, ∆Q – кривую, то в потенциодинамическом методе аналогичная операция позволяет перейти от I, t - к I, E – кривой.
Для идеально поляризуемого электрода наблюдаемый в потенциодинамических условиях ток, очевидно, является током заряжения двойного электрического слоя:
I = Cд.с.*(dE/dt) = Cд.с.* v.
На совершенно поляризуемом платиновом электроде наряду с заряжением двойного слоя протекают фарадеевские процессы снятия – посадки адсорбированных водорода и кислорода, а поэтому протекающий ток равен:
I = Cпол *(dE/dt) = Cпол *v.
Следовательно, I, E – кривые, регистрируемые в потенциодинамических условиях, эквивалентны дифференциалу E, ∆Q – кривых, получаемых в гальваностатических условиях, а величина тока в потенциодинамических условиях прямо пропорциональна скорости развертки потенциала.
Полная потенциодинамическая кривая представлена на Рис.2.
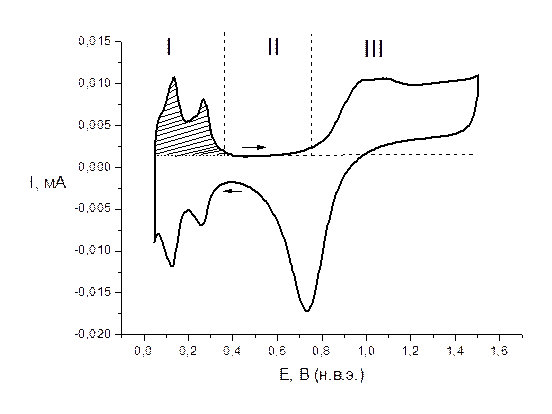
Рис.2
Циклическая потенциодинамическая кривая Pt-электрода в 0,5М растворе H2SO4:
I – водородная, II - двойнослойная, III – кислородная области
На анодной ветви потенциодинамической кривой (соответствующей изменению потенциала в анодном направлении) видны два пика окисления адсорбированного водорода (водородная область потенциодинамической кривой), затем следует двойнослойная область потенциалов и область посадки адсорбированного кислорода (кислородная область). Возрастание тока при Е > 1,45 В (относ. н.в.э.) отвечает процессу выделения молекулярного кислорода. При изменении потенциала в катодном направлении наблюдаются четкий максимум восстановления адсорбированного кислорода, слабо выраженная двойнослойная область и максимумы посадки адсорбированного водорода. Максимумы ионизации – посадки водорода при менее анодном потенциале называют максимумами слабо связанного водорода, а более анодные максимумы – максимумами прочно связанного водорода.
По зависимости потенциалов и токов пиков от скорости развертки потенциала метод циклической вольтамперометрии позволяет определять обратимые и необратимые электрохимические процессы, а также адсорбционные процессы. Так для обратимых процессов, контролируемых диффузией, потенциалы пиков не зависят от скорости развертки потенциала, а разность потенциалов катодного и анодного пиков равна ∆Е =58/n (мВ), где n – число переносимых электронов, токи в пиках линейно зависят от корня квадратного из скорости развертки потенциала. Для необратимых процессов разность потенциалов катодного и анодного пиков значительно больше, чем для обратимых процессов, причем потенциалы пиков линейно зависят от логарифма скорости развертки потенциала, а зависимость токов в пиках от скорости развертки линейна в координатах I – v1\2. Потенциалы пиков адсорбционных процессов не зависят от скорости развертки потенциала, а токи пиков прямо пропорциональны скорости развертки.
Дата добавления: 2015-07-20; просмотров: 41 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Метод кривых заряжения | | | Экспериментальная часть |