
Читайте также:
|
Вся тепловая энергия (теплота), подведенная к системе, расходуется на изменение ее внутренней энергии и на совершение работы.
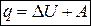 (1.14)
(1.14)
или 
 dq > 0 положительная теплота;
dq > 0 положительная теплота;
 dq < 0 отрицательная теплота.
dq < 0 отрицательная теплота.
1.4. Термодинамические процессы идеальных газов.
I. Изохорный процесс
Пример: охлаждение и нагревание
газа в в герметичном сосуде.

Рис. 1.3. Изохорный процесс в PV – диаграмме
График – изохора 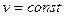

 ,
,  Поделим 1-е уравнение на 2-е:
Поделим 1-е уравнение на 2-е:
 Давление изменяется прямо пропорционально температуре газа.
Давление изменяется прямо пропорционально температуре газа.
Уравнение 1-го закона термодинамики
 В изохорном процессе вся подведенная теплота идет на увеличение внутренней энергии.
В изохорном процессе вся подведенная теплота идет на увеличение внутренней энергии.
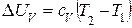 (1.15)
(1.15)
II. Изобарный процесс.

Рис. 1.4. Изобарный процесс в PV – диаграмме
Пример: процесс нагревания воздуха в негерметичном помещении.
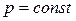
График – изобара.
Из уравнения состояния газа следует:
 Объем газа изменяется прямо пропорционально его температуре.
Объем газа изменяется прямо пропорционально его температуре.
 В изобарном процессе теплота, подведенная к рабочему телу,
В изобарном процессе теплота, подведенная к рабочему телу,
расходуется на изменение внутренней энергии тела и на
совершение работы.

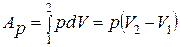 или
или
 т.к.
т.к.  и
и  т.е.
т.е. 
 универсальная газовая
универсальная газовая
постоянная

 Если принять, что
Если принять, что  , то R это работа, производимая 1 кг газа при его нагревании на 10С в изобарном процессе.
, то R это работа, производимая 1 кг газа при его нагревании на 10С в изобарном процессе.
 (1.16)
(1.16)
 или
или 
Энергию, равную сумме внутренней энергии и произведение давления на объем называют энтальпией.
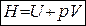 , Дж (1.17)
, Дж (1.17)
III. Изотермический процесс

Рис. 1.5. Изотермический процесс в PV – диаграмме
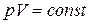
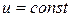
График – изотерма
Процесс 1-2 – изотермическое расширение газа;
Процесс 2-1 – изотермическое сжатие газа.

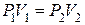
 (1.18)
(1.18)
Отношение абсолютных давлений обратно пропорционально отношению объемов.
 (1.19)
(1.19)
Вся теплота, подведенная к газу в изотермическом процессе, расходуется на совершение механической работы.
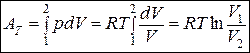 (1.20)
(1.20)
т.к. 
IV. Адиабатный процесс.
Процесс, осуществляющийся без подвода и отвода теплоты, т.е. dq=0, q=0.
Практически адиабатный процесс происходит при расширении или сжатии газа в цилиндре и протекающий настолько быстро, что теплообмен с окружающей средой не успевает произойти.

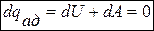
 (1.21)
(1.21)
Следовательно, работа в процессе адиабатного расширения осуществляется за счет изменения внутренней энергии рабочего тела.


 (1.22)
(1.22)
Уравнение адиабаты
 (1.23)
(1.23)
где 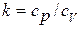 - показатель адиабаты
- показатель адиабаты
График – адиабата – неравнобокая гипербола, более крутая, чем изотерма.
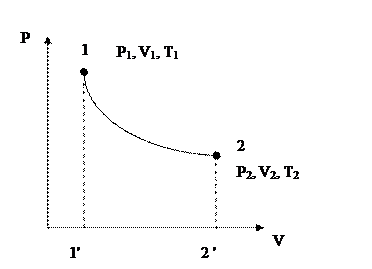
Рис. 1.6. Адиабатный процесс в PV – диаграмме.
V. Политропный процесс.
В политропных процессах происходит изменение всех параметров.
Уравнение политропных процессов:
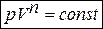
n – постоянная для данного процесса величина – показатель политропы с значением от 0 до ±  .
.
Все рассмотренные термодинамические процессы являются частными случаями политропных процессов:
 n=0,
n=0, 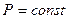 изобарный процесс
изобарный процесс
 n=1,
n=1,  изотермический процесс
изотермический процесс
 n=k,
n=k, 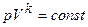 адиабатный процесс
адиабатный процесс
 n=±
n=±  ,
, 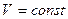 изохорный процесс
изохорный процесс
Для политропного процесса:
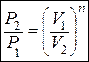 ,
,  ,
,  (1.24)
(1.24)
 (1.25)
(1.25)
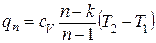
1.5. Второй закон термодинамики. Цикл Карно.
Циклом называется последовательность определенных термодинамических процессов, в которых рабочее тело, протерпев ряд изменений, возвращается в первоначальное состояние.
В основу расчета тепловых двигателей положены идеальные круговые процессы, циклы. Процесс подвода теплоты в идеальных циклах рассматривается без изменения химического состава рабочего тела. В реальных циклах процесс подвода теплоты происходит в процессе сжигания топлива и рабочим телом в двигателях внутреннего сгорания являются продукты, образующиеся при горении.
Процесс отвода теплоты в идеальных циклах предусматривает наличие холодильника. В реальных циклах этот процесс осуществляется выпуском отработавшего рабочего тела в атмосферу. Процессы расширения и сжатия в реальных циклах сопровождаются теплообменом и не могут точно соответствовать адиабатным.

а) б)
Рис. 1.7. Круговой цикл в РV – диаграмме
На круговом цикле (рис. 1.7, а) на участке 1 – а – 2 к рабочему телу подводится теплота q1, рабочее тело расширяется и производит работу, равную площади 1 – а – 2 – 3 – 4 – 1.
На участке 2 – б – 1 от рабочего тела отводится теплота q2 (или выпускаются отработанные газы), а также рабочее тело сжимается, на что затрачивается отрицательная работа внешних сил соответствующая площади 2 – б – 1 – 4 – 3 – 2. В т. 1 цикл завершается и рабочее тело приобретает первоначальные параметры. Следовательно, внутренняя энергия рабочего тела не изменятся ( ).
).
На основании 1 – го закона термодинамики для цикла имеем:
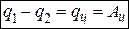 (1.26)
(1.26)
Ац – произведенная полезная работа.
Рассмотренный цикл называется прямым. По прямым циклам работают все тепловые двигатели.
Для непрерывной работы двигателя, превращающего теплоту в механическую энергию, необходимо иметь источник теплоты с высокой температурой Т1 и сток теплоты (холодильник) с низкой температурой Т2. При этом всегда желательно, чтобы в работу превратилась как можно большая доля подведенной теплоты.
Термический КПД цикла:
 (1.27)
(1.27)
Термический КПД цикла – это отношение количества теплоты, превращенной в полезную работу, к количеству подведенной теплоты.
Рассмотрим цикл, осуществляющийся в обратном направлении, т.е. против часовой стрелки. Здесь линия сжатия расположена выше линии расширения, т.е. работа осуществляется на сжатие. Такой цикл называется обратным.
Положительная работа 1 – а – 2 – 3 – 4 меньше отрицательной 2 – б – 1 – 4 – 3, поэтому полезная работа не производится, а затрачивается работа от внешнего источника энергии. Теплота q2 передается рабочему телу от холодного источника, а теплота q1 отдается горячему источнику. В обратном цикле передача тепловой энергии происходит от холодного тела к горячему, при этом затрачивается работа, которая превращается в тепловую энергию.
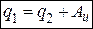 (1.28)
(1.28)
Обратные циклы осуществляются в холодильных установках и тепловых насосах. Эффективность их работы оценивается холодильным коэффициентом:
 (1.29)
(1.29)
Холодильный коэффициент – это отношение количества теплоты (тепловой энергии), переданное от холодного тела к количеству тепловой энергии, эквивалентной затраченной работе цикла Ац.
В результате анализа множества циклов французский ученый Сади Карно нашел цикл с максимальным значением КПД.

Рис. 1.8. Перемещение поршня и изменение параметров рабочего тела в цикле Карно.
т. 1 – начало цикла: р1, V1, T1
1-2 – изотермическое расширение рабочего тела при температуре Т1 с подводом тепловой энергии q1 и работой изотермического расширения 1 – 2 – 6 – 8 – 1.
2-3 – подвода теплоты нет, расширение по адиабате 2-3 до крайнего правого положения поршня 3. Работа адиабатного расширения 2 – 3 – 5 – 6 – 2.
3-4 – процесс сжатия рабочего тела при температуре Т2 – изотермический процесс – с отводом теплоты q2 и работой 3 – 4 – 7 – 5 – 3.
4-1 – процесс сжатия без отвода теплоты по адиабате 4-1, работа сжатия 4 – 1 – 8 – 7 – 4.
Таким образом, полезная работа определяется площадью 1 – 2 – 3 – 4 – 1 как разность площадей 1 – 2 – 3 – 5 – 8 – 1 и 3 – 4 – 1 – 8 – 5 – 3.
Термический КПД цикла Карно определяется по выражению:
 (1.30)
(1.30)
В цикле Карно принято равенство отношений удельных объемов
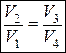 (1.31)
(1.31)
С учетом последнего выражения
 (1.32)
(1.32)
Из формулы (1.32) следует:
Единице термический КПД цикла Карно мог бы быть равен при Т2=0 или Т1=∞,
что неосуществимо.
Реально создать двигатель, работающий по циклу Карно невозможно, т.к. процессы изотермического подвода и отвода тепловой энергии, а также адиабатного расширения и сжатия практически неосуществимы.
Цикл Карно является эталоном с максимальным КПД превращения тепловой энергии в работу. Реальный тепловой двигатель тем совершеннее, чем ближе его КПД к КПД цикла Карно, протекающего при тех же температурах.
Обратный цикл Карно также является эталоном для работы холодильных установок.
Холодильный коэффициент цикла Карно:
 (1.33)
(1.33)
Дата добавления: 2015-07-25; просмотров: 198 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Показатели тепловой экономичности ТЭЦ | | | Второй закон термодинамики 1 страница |