
|
Читайте также: |
1. Что называют буферными системами? Укажите состав важнейших буферных систем организма человека и их биологическую роль. На примере любой буферной системы опишите механизм их действия.
Буферные системы – это соединения, противодействующие резким изменениям концентрации ионов Н+, включающие кислотно-основные пары: слабое основание (анион, А–) и слабая кислота (Н-А). Они вступают в действие моментально и через несколько минут их эффект достигает максимума возможного.
Существует несколько буферных систем жидкостей организма – бикарбонатная, фосфатная, белковая, гемоглобиновая.
Бикарбонатная буферная система
Эта система состоит из бикарбонат-иона (НСО3–) и угольной кислоты (Н2СО3),. В норме отношение HCO3– к H2CO3 равно 20: 1. Работа этой системы неразрывно и тесно связана с легкими.
При поступлении в кровь более сильной кислоты, чем угольная, ионы бикарбоната натрия взаимодействуют с ней, происходит реакция обмена и образуется соответствующая соль и угольная кислота. В результате, благодаря связыванию введенной в систему кислоты, концентрация ионов водорода значительно понижается.
NaНСО3 + Н-Анион → Н2СО3 + Na+ + Анион–
При поступлении оснований они реагируют с угольной кислотой и образуют соли бикарбонатов:
H2CO3 + Катион-ОН → Катион+ + HCO3– + Н2О
Возникающий при этом дефицит угольной кислоты компенсируется уменьшением выделения CO2 легкими.
При накоплении угольной кислоты в крови не происходит параллельного значимого увеличения концентрации НСО3–, т.к. угольная кислота очень плохо диссоциирует.
Благодаря работе бикарбонатного буфера концентрация водородных ионов понижается по двум причинам:
· угольная кислота является очень слабой кислотой и плохо диссоциирует,
· в крови легких благодаря присутствию в эритроцитах фермента карбоангидразы, угольная кислота быстро расщепляется с образованием CO2, удаляемого с выдыхаемым воздухом:
Н2СО3 → Н2О + СО2↑
Кроме эритроцитов, значительная активность карбоангидразы отмечена в эпителии почечных канальцев, клетках слизистой оболочки желудка, коре надпочечников и клетках печени, в незначительных количествах – в центральной нервной системе, поджелудочной железе и других органах.
Фосфатная буферная система
Фосфатная буферная система составляет около 1-2% от всей буферной емкости крови и до 50% буферной емкости мочи. Она образована дигидрофосфатом (NaH2PO4) и гидрофосфатом (Na2HPO4) натрия. Первое соединение слабо диссоциирует и ведет себя как слабая кислота, второе обладает щелочными свойствами. В норме отношение HРO42– к H2РO4– равно 4: 1.
При взаимодействии кислот (ионов водорода) с двузамещенным фосфатом натрия (Na2HPO4) натрий вытесняется, образуется натриевая соль дигидрофосфата (H2PO4–). В результате, благодаря связыванию введенной в систему кислоты, концентрация ионов водорода значительно понижается.
HPO42– + Н-Анион → H2PO4– + Анион–
При поступлении оснований избыток ОН– групп нейтрализуется имеющимися в среде Н+, а расход ионов Н+ восполняется повышением диссоциации NaH2PO4.
H2PO4– + Катион-ОН → Катион+ + HPO42– + Н2О
Основное значение фосфатный буфер имеет для регуляции pH интерстициальной жидкости и мочи. В моче роль его состоит в сбережении бикарбоната натрия за счет дополнительного иона водорода (по сравнению с NaHCO3) в составе выводимого NaH2PO4:
Na2HPO4 + Н2СО3 → NaH2PO4 + NaНСО3
Кислотно-основная реакция мочи зависит только от содержания дигидрофосфата, т.к. бикарбонат натрия в почечных канальцах реабсорбируется.
Белковая буферная система
Буферная мощность этой системы составляет 5% от общей буферной емкости крови.
Белки плазмы, в первую очередь альбумин, играют роль буфера благодаря своим амфотерным свойствам. В кислой среде подавляется диссоциация СООН-групп, а группы NH2 связывают избыток Н+, при этом белок заряжается положительно. В щелочной среде усиливается диссоциация карбоксильных групп, образующиеся Н+ связывают избыток ОН–-ионов и pH сохраняется, белки выступают как кислоты и заряжаются отрицательно.
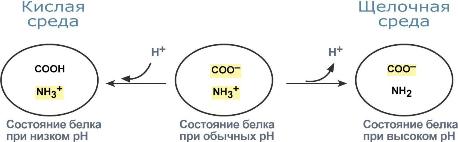
Изменение заряда буферных групп белка при различных рН
Гемоглобиновая буферная система
Наибольшей мощностью обладает гемоглобиновый буфер, который можно рассматривать как часть белкового. На него приходится до 30% всей буферной емкости крови. В буферной системе гемоглобина существенную роль играет гистидин, который содержится в белке в большом количестве. Изоэлектрическая точка гистидина равна 7,6, что позволяет гемоглобину легко принимать и легко отдавать ионы водорода при малейших сдвигах физиологической рН крови (в норме 7,35-7,45).
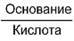
Данный буфер представлен несколькими подсистемами:
| Гемоглобиновые подсистемы | |||
| 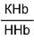
| 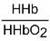
| 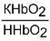
|
Пара ННb/ННbО2 является основной в работе гемоглобинового буфера. Соединение ННbО2 является более сильной кислотой по сравнению с угольной кислотой, HHb - более слабая кислота, чем угольная. Установлено, что ННbО2 в 80 раз легче отдает ионы водорода, чем ННb.
Работа гемоглобинового буфера неразрывно связана с дыхательной системой (Газобмен в легких и тканях).
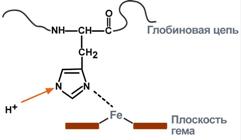 Присоединение ионов водорода к остатку гистидина дезоксигемоглобина
Присоединение ионов водорода к остатку гистидина дезоксигемоглобина
|
В легких после удаления СО2 (угольной кислоты) происходит защелачивание крови. При этом присоединение О2 к дезоксигемоглобину H-Hb образует кислоту ННbО2 более сильную, чем угольная. Она отдает свои ионы Н+ в среду, предотвращая повышение рН:
Н-Hb + O2 → [H-HbO2] → НbO2 + Н+
В капиллярах тканей постоянное поступление кислот (в том числе и угольной) из клеток приводит к диссоциации оксигемоглобина НbO2 (Эффект Бора) и связыванию ионов Н+ в виде Н-Hb:
НbO2+ Н+ → [H-HbO2] → Н-Hb + O2
2. Опишите особенности химического состава и строения белков. Что понимается под первичной, вторичной, третичной и четвертичной структурой молекулы белка. Напишите уравнение реакции образования депептида из любых аминокислот.
Белки характеризуются определенным элементарным составом. Химический анализ показалналичие во всех белках углерода (50-55%),кислорода(21-24%),азота (15-18%),водорода (6-7%),серы (0,3-2,5%). В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы, в различных, часто очень малых количествах.
По химическому составу белки представляют собой полимеры, построенные из остатков a-аминокислот.
Структура
Все белки они построены по единому принципу и имеют четыре уровня организации: первичную, вторичную, третичную, а отдельные из них и четвертичную структуры.
Первичная структура
Представляет собой линейную цепь аминокислот (полипептид), расположенных в определенной последовательности с четким генетически обусловленным порядком чередования и соединенных между собой пептидными связями.
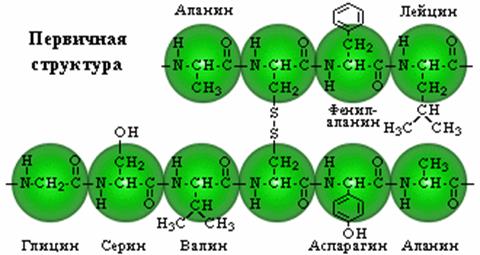

Пептидная связьобразуется за счет a-карбоксильной группы одной аминокислоты и a-аминной группы другой
К настоящему времени установлены последовательности аминокислот для нескольких тысяч различных белков.
При записи аминокислотной последовательности в полипептидных или олигопептидных цепях с помощью сокращенной символики предполагается, если это особо не оговорено, что a-аминогруппа находится слева, а a-карбоксильная группа — справа. Соответствующие участки полипептидной цепи называют N-концом (аминным концом) и С-концом (карбоксильным концом), а аминокислотные остатки — соответственно N-концевым и С-концевым остатками.
Вторичная структура
Вторичной структурой называют конформацию, которую образует полипептидная цепь. Для высокомолекулярных белков характерна структура спирали.
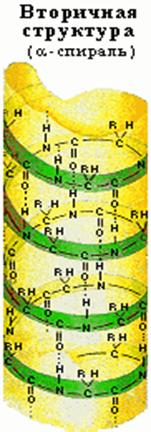 Впервые такая структура была обнаружена при изучении волос и шерсти -a- кератина (Л. Полинг). Ее назвали a-структурой или a-спиралью. Обычно в природных продуктах встречаются белки со строением правой спирали, хотя известна и структура левой спирали.
Впервые такая структура была обнаружена при изучении волос и шерсти -a- кератина (Л. Полинг). Ее назвали a-структурой или a-спиралью. Обычно в природных продуктах встречаются белки со строением правой спирали, хотя известна и структура левой спирали.
Спиральные структуры белка.
Для полипептидных цепей известно несколько различных типов спиралей. Если при наблюдении вдоль оси спирали она удаляется от наблюдателя по часовой стрелке, то спираль считается правой (правозакрученной), а если удаляется против часовой стрелки — левой (левозакрученной). Наиболее распространена правая a-спираль). Идеальная a-спираль имеет шаг 0,54 нм и число однотипных атомов на один виток спирали 3,6. строение спирали стабилизируется внутримолекулярными водородными связями.
В природных белках существуют лишь правозакрученные a-спиральные конформации полипептидных цепей, что сопряжено с наличием в белковых телах аминокислот только L-ряда (за исключением особых случаев).
При растяжении a-кератина образуется вещество с другими свойствами - b-кератин. При растяжении спираль макромолекулы белка превращается в другую структуру, напоминающую линейную. Отдельные полипептидные цепи здесь связаны межмолекулярными водородными связями. Эта структура называется b-структурой (структура складчатого листа, складчатого слоя)
Складчатые структуры белка.
Одним из распространенных примеров складчатой периодической структуры белка являются так называемые b-складки, состоящие из двух фрагментов, каждый из которых представлен полипептидом.
b-складки также стабилизируются водородными связями между атомом водорода аминной группы одного фрагмента и атомом кислорода карбоксильной группы другого фрагмента. При этом фрагменты могут иметь как параллельную, так и антипараллельную ориентацию относительно друг друга.
Для того чтобы два участка полипептидной цепи располагались в ориентации, благоприятствующей образованию b-складок, между ними должен существовать участок, имеющий структуру, резко отличающийся от периодической.
Возникновение a- и b-структур в белковой молекуле является следствием того, что аминокислоты и в составе полипептидных цепей сохраняют присущую им способность к образованию водородных связей. Таким образом, крайне важное свойство аминокислот — соединяться друг с другом водородными связями в процессе образования кристаллических препаратов — реализуется в виде a-спиральной конформации или b-структуры в белковой молекуле. Следовательно, возникновение указанных структур допустимо рассматривать как процесс кристаллизации участков полипептидной цепи в пределах одной и той же белковой молекулы.
Третичная структура
 — общее расположение в пространстве составляющих молекул одной или нескольких полипептидных цепей, соединенных ковалентными связями. То есть третичная конфигурация — реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль, которая в свою очередь свернута спиралью. У такой структуры в пространстве имеются выступы и впадины с обращенными наружу функциональными группами.
— общее расположение в пространстве составляющих молекул одной или нескольких полипептидных цепей, соединенных ковалентными связями. То есть третичная конфигурация — реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль, которая в свою очередь свернута спиралью. У такой структуры в пространстве имеются выступы и впадины с обращенными наружу функциональными группами.
Полное представление о третичной структуре дают координаты всех атомов белка
Третичная структура формируется в результате нековалентных взаимодействий (электростатические, ионные, силы Ван-дер-Ваальса и др.) боковых радикалов, обрамляющих a-спирали и b-складки, и непериодических фрагментов полипептидной цепи. Среди связей, удерживающих третичную структуру, следует отметить:
а) дисульфидный мостик (–S–S–) между двумя остатками цистеина;
б) сложноэфирный мостик (между карбоксильной группой и гидроксильной группой);
в) солевой мостик (между карбоксильной группой и аминогруппой);
г) водородные связи между группами -СО - и -NH-;
Третичной структурой объясняется специфичность белковой молекулы, ее биологическая активность.
Первые пространственные модели молекул белка — миоглобина и гемоглобина — построили в конце 50-х гг. XX в. А в конце столетия была определена третичная структура уже нескольких тысяч белков.
Четвертичная структура
У большинства белков пространственная организация заканчивается третичной структурой, но для некоторых белков с молекулярной массой больше 50-100 тысяч, построенных из несколько полипептидных цепей характерна четвертичная.
Сущность такой структуры в объединении несколько полимерных цепей были в единый комплекс. Такой комплекс также рассматривается как белок, состоящий из нескольких субъединиц. Белки, состоящие из нескольких субъединиц, широко распространены в природе (гемоглобин, вирус табачной мозаики, фосфорилаза, РНК-полимераза).. Наличие нескольких субъединиц важно в функциональном отношении — оно увеличивает степень насыщения кислородом.
 Четвертичная структура (клубок белков)
Четвертичная структура (клубок белков)
Четвертичная структура стабилизируется в основном силами слабых воздействий:
а) водородная; б) гидрофобная; в) ионные; г) ковалентные (дисульфидные, пептидные).
Уравнение реакции образования дипептида из любых аминокислот:
При образовании дипептида в реакцию вступают две аминокислоты.
У одной кислоты карбоксильная группа вступает в реакцию,а у другой аминогруппа.
сначала напишем формулы аминокислот
аланин - CH3-CH(NH2)-COOH
серин - NH2-CH(CH2-OH)-COOH
Поэтому возможны два варианта:
1) Взаимодействует карбоксил аланина с аминогруппой серина
CH3-CH(NH2)-COOH + NH2-CH(CH2-OH)-COOH ==>
CH3-CH(NH2)-CO-NH-CH(CH2-OH)-COOH + H2O
Получается дипептид - аланилсерин
2) Взаимодействует карбоксил серина с аминогруппой аланина
OH-CH2-CH(NH2)-COOH + NH2-CH(CH3)-COOH ==>
OH-CH2-CH(NH2)-CO-NH-CH(CH3)-COOH
Получается дипептид - серилаланин
3. Опишите химический состав и строение жиров. От чего зависит температура плавления жира? Опишите (с использованием структурных формул) важнейшие химические свойства жиров. Каковы функции жиров в организме человека?
Дата добавления: 2015-07-25; просмотров: 68 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Окислительно-восстановительные реакции | | | Химические свойства жировопределяются принадлежностью их к классу сложных эфиров. Поэтому наиболее характерная для них реакция – гидролиз |