
Читайте также:
|
Сг(ОН)2 проявляет только основные свойства, Сг(ОН)3 амфотерен и растворяется в растворах кислот и щелочей. При взаимодействии с раствором щелочи образуются гидроксокомплексы [Сг(ОН)4]‾ и [Сг(ОН)6]3‾: Cr(OH)3 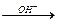 [Сг(ОН)4]‾
[Сг(ОН)4]‾ 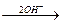 [Сг(ОН)6]3‾.
[Сг(ОН)6]3‾.
Гидроксид хрома(VI) является кислотой.
3.1. Получение и кислотно-основные свойства гидроксида хрома(II)
Поскольку соединения хрома(II) являются сильными восстановителями, при их получении необходима защита от кислорода воздуха.
В пробирку внесите несколько гранул металлического цинка и прилейте 2-3 мл раствора хлорида хрома(III), подкисленного соляной кислотой. Раствор покройте тонким слоем бензина и выдержите несколько минут, пока раствор не приобретет голубую окраску из-за образования СгС12. В другую пробирку поместите 5 капель концентрированного (6 моль/л) раствора NaOH и быстро вылейте в нее полученный раствор. Выпавший осадок Сг(ОН)2 взболтайте и разделите полученную взвесь на две пробирки. В одну добавьте 2-4 капли 20 %-ной H2SO4, в другую – 2-4 капли 6 моль/л раствора NaOH. Отметьте происходящее.
3.2. Получение и кислотно-основные свойства гидроксида хрома(III)
В пробирку налейте ~1 мл 0,1 моль/л раствора СгС13 и добавьте 2-3 капли 10 %-ного раствора NaOH. Осадок взболтайте и суспензию разлейте в две пробирки. В одну добавьте раствор 20 %-ной H2SO4, а в другую – раствор 6 моль/л NaOH до полного растворения осадков. Отметьте происходящее.
Вопросы и задания

1. Опишите наблюдения. Отметьте цвета растворов и осадков.
2. Напишите уравнения соответствующих реакций.
3. Сравните кислотно-основные свойства оксидов и гидроксидов хрома в различных степенях окисления.
4. Зачем при получении гидроксида хрома(II) добавляется бензин?
Опыт 4. Окислительно-восстановительные свойства соединений ванадия (II), (III), (IV), (V)
Поскольку ионы ванадия в различных степенях окисления имеют различную окраску (V2+ – светло-фиолетовый, V3+ – зеленый, VO2+ – ярко-синий и VO2+ – темно-желтый), пробы, соответствующие необходимой степени окисления, отбирают в процессе протекания реакции.
Окислительные свойства у соединений ванадия в различных степенях окисления проявляются при их взаимодействии с йодид-ионом (из которого окислители выделяют свободный йод). Например, ионы VO2+ (форма, в которой ванадий(V) существует в кислых средах) взаимодействуют с иодидом по уравнению:
2VО2+ + 4Н+ + 2I‾ = 2VO2+ + I2 + 2H2O.
Для обнаружения восстановительных свойств вещества проводится реакция со свободным йодом, например:
2V2+ + I2 = 2V3+ + 2I‾,
2V3+ + 2H2O + I2 = 2VO2+ + 2I‾+ 4Н+.
В растворе наблюдается исчезновение окраски, характерной для молекулярного йода.
4.1. Получение и окислительные свойства соединений ванадия(V)
В коническую колбу на 50 мл налейте ~10 мл 0,1 моль/л раствора метаванадата натрия NaVO3 и добавьте столько же концентрированной НС1. Наблюдайте появление желтого окрашивания раствора вследствие образования иона VO2+. Часть полученного раствора VO2C1 отберите в две пробирки и сохраните для дальнейшего исследования.
В оставшийся в колбе раствор поместите несколько гранул цинка. В процессе реакции восстановления VO2+ цинком наблюдайте последовательное образование ионов: VO2+ (ярко-синий), V3+ (зеленый) и V2+ (светло-фиолетовый) в результате протекания реакций:
2VO2+ + Zn + 4H+ = 2VO2+ + Zn2+ + 2H2O;
2VO2+ + Zn + 4H+ = 2V3+ + Zn2+ + 2H2O;
2V3+ + Zn = 2V2+ + Zn2+.
Учтите, что в начале реакции раствор окрашивается в зеленый цвет из-за образования смеси веществ желтого (VO2+) и синего (VO2+) цвета. По ходу реакции отберите в 6 пробирок по 2 пробы синего (VO2+), зеленого (V3+) и светло-фиолетового (V2+) растворов.
4.2. Получение и окислительно-восстановительные свойства соединений ванадия(V)
В первую пробу каждого из растворов, отобранных в опыте 4.1, для определения окислительных свойств соединений ванадия(IV, III, II) прибавьте по 2-3 капли 0,1 моль/л раствора КI и 4-5 капель толуола. По изменению окраски толуольного слоя отметьте пробирки, в которых выделился йод. Во вторые пробы для проверки наличия восстановительных свойств добавьте по 2-3 капли йодной воды и толуол. По исчезновению окраски толуольного слоя отметьте пробирки, в которых I2 восстановился до I‾. Наблюдения занесите в таблицу 3.
Таблица 3
| Ионы ванадия | Степень кисления ванадия | Цвет | Наблюдения после взаимодействия с | |
| ванадия | окисления | иона | 0,1 моль/л раствором КI + то-луол (проба на окислительные свойства) | I2(раствор) + толуол (проба на восстановительные свойства) |
| VO2+ | +5 | желтый | ||
| VO2+ | +4 | ярко-синий | ||
| V3+ | +3 | зеленый | ||
| V2+ | +2 | светло-фиол |
Вопросы и задания

1. Опишите наблюдения. Отметьте окраску растворов.
2. Напишите уравнения реакций, соответствующие превращениям: VO3‾ → VO2+ → VO2+ → V3+ → V2+..
3. Сравните кислотно-основные свойства оксидов и гидроксидов ванвдия в различных степенях окисления.
4. Какие из ионов ванадия при взаимодействии с КI проявили свойства окислителя, а при взаимодействии с I2 – свойства восстановителя?
Дата добавления: 2015-07-25; просмотров: 169 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Исследование зависимости химических свойств соединений переходных металлов от степени окисления металла | | | Сопоставление окислительно-восстановительных свойств соединений d-металлов четвертого, пятого и шестого периодов |